1 . 随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_______ kJ·mol-1。
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为_______ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为_______ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:
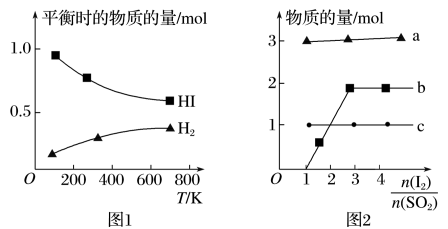
①反应H2(g)+I2(g) 2HI(g)的ΔH
2HI(g)的ΔH_______ 0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++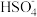 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是_______ (填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)ΔH=?已知该反应中相关化学键的键能数据如下:共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需的甲醇工业上有多种方法合成。用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,阴极上的电极反应为
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3molPbI2的反应中,转移电子的物质的量为
(4)分解HI曲线和液相法制备HI反应曲线分别如下图1和图2所示:

①反应H2(g)+I2(g)
 2HI(g)的ΔH
2HI(g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++
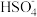 +2I-,I2+I-
+2I-,I2+I-
 ,图2中曲线c代表的微粒是
,图2中曲线c代表的微粒是
您最近一年使用:0次
名校
2 . 将E(s)和F(g)加入密闭容器中,在一定条件下发生反应E(s)+4F(g) G(g),已知该反应的平衡常数如表所示。下列说法正确的是
G(g),已知该反应的平衡常数如表所示。下列说法正确的是
 G(g),已知该反应的平衡常数如表所示。下列说法正确的是
G(g),已知该反应的平衡常数如表所示。下列说法正确的是| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A.上述反应是熵增反应 |
B.25℃时,反应G(g) E(s)+4F(g)的平衡常数是0.5 E(s)+4F(g)的平衡常数是0.5 |
| C.在80℃时,测得某时刻F、G的浓度均为0.5mol·L-1,则此时v正>v逆 |
| D.恒温恒容下,向容器中再充入少量G(g),达到新平衡时,G的体积百分含量将增大 |
您最近一年使用:0次
2021-03-06更新
|
646次组卷
|
8卷引用:2014-2015学年重庆市南开中学高一下学期期末化学试卷
3 . 下列用于解释事实的方程式书写不正确的是
| A.某家用管道疏通剂(含铝粒和苛性钠)疏通管道:Al3++3OH-=Al(OH)3↓ |
B.铁盐可作净水剂: |
C.向重铬酸钾溶液中滴加少量浓硫酸,溶液橙色加深: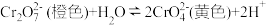 |
D.用饱和碳酸钠溶液处理水垢中的硫酸钙: |
您最近一年使用:0次
4 . NO的处理与减排是烟气污染物控制的重点和难点,相关研究引起了国内外的广泛关注。
(1)理论上可采用加热使NO分解的方法处理: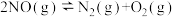 ,反应的部分数据如下表:
,反应的部分数据如下表:
通过计算得出高于7089℃时反应无法自发进行,试判断b____ 0(填“<”、“>”或“=”);反应的平衡常数表达式为____ ;实际反应时发现加热至600℃时NO仍没有明显分解,试解释原因___ 。
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为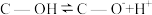 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化: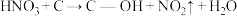
预氧化:
预氧化:
吸附: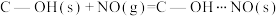
NO吸附实验分别在25℃和55℃下进行,将一定比例的 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
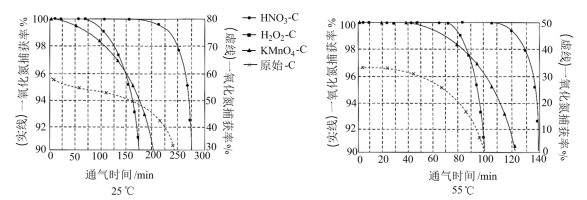
已知:NO捕获率=
请回答:
①下列描述正确的是_______
A.25℃下原始-C在通气约175分钟后吸附效果超过了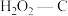
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动
C.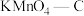 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的
②其他条件不变,55℃下增大烟气中水蒸气含量后,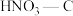 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线____________ 。
③相比其他预氧化试剂处理的活性炭,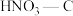 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释_______ 。
(1)理论上可采用加热使NO分解的方法处理:
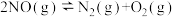 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
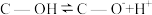 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
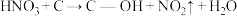
预氧化:

预氧化:

吸附:
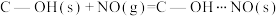
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
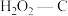
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
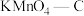 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
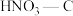 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
20-21高二·浙江·期中
名校
5 . 下列事实不能用勒夏特列原理解释的是
| A.黄绿色的氯水光照后颜色变浅 |
| B.2NO2(红棕色)⇌N2O4(无色),加压后颜色先变深后变浅 |
| C.对于反应2HI(g)⇌H2(g)+I2(g) △H>0,缩小容器的体积可使颜色变深 |
| D.打开冰镇啤酒瓶,把啤酒倒入玻璃杯中,杯中立即泛起大量泡沫 |
您最近一年使用:0次
名校
解题方法
6 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
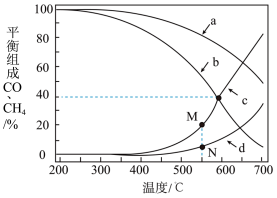
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
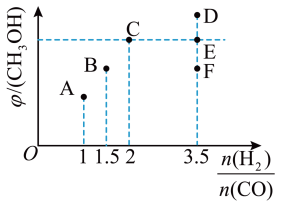
(5)当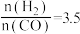 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
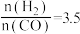 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
821次组卷
|
4卷引用:吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题
吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省扬州中学2021-2022学年高二上学期期中考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
7 . 在新制的饱和氯水中,若改变某一条件,下列叙述正确的是
A.再通入少量氯气, 减小 减小 |
| B.光照过程中,有气泡冒出,溶液的导电性减弱 |
| C.加入少量的NaHSO3固体,pH增大,溶液漂白性增强 |
| D.加入少量的NaHCO3固体,pH增大,溶液漂白性增强 |
您最近一年使用:0次
名校
8 . 下列事实不能用勒夏特列原理解释的是
A.用 溶液将锅炉水垢中的 溶液将锅炉水垢中的 转化为 转化为 |
B.恒温下,由 、 、 、 、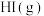 组成的平衡体系加压后颜色变深 组成的平衡体系加压后颜色变深 |
C.配制 溶液:将 溶液:将 固体先溶解于浓盐酸,再稀释到所需浓度 固体先溶解于浓盐酸,再稀释到所需浓度 |
D.石蕊(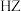 )可发生电离: )可发生电离: ,可用作酸碱指示剂 ,可用作酸碱指示剂 |
您最近一年使用:0次
2021-03-04更新
|
254次组卷
|
3卷引用:山东省德州市2020-2021学年高二上学期期末统考化学试题
名校
9 . 有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g) 2c(g) ΔH1<0
2c(g) ΔH1<0
乙:x(g)+3y(g) 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是

甲:a(g)+b(g)
 2c(g) ΔH1<0
2c(g) ΔH1<0乙:x(g)+3y(g)
 2z(g) ΔH2>0
2z(g) ΔH2>0起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是

| A.在反应器恒温下,向乙中通入z气体,y的物质的量浓度增大 |
| B.在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大 |
| C.在反应器绝热下,向乙中通入z气体,反应器中温度升高 |
| D.在反应器绝热下,向甲中通入惰性气体,c的物质的量不变 |
您最近一年使用:0次
2021-03-01更新
|
543次组卷
|
8卷引用:重庆市巴蜀中学2017-2018学年高二上学期期末考试化学试题
10 . 学习“化学平衡移动原理”后,联系生产、生活,下列说法错误的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.合成氨反应,为提高氨的产率,应采取高温高压的措施 |
| C.啤酒瓶开启后,马上泛起大量泡沫 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,利用平衡移动原理缓解病情 |
您最近一年使用:0次






