名校
1 . 对于可逆反应:
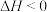 ,下列措施能加快反应速率且使平衡逆向移动的是
,下列措施能加快反应速率且使平衡逆向移动的是

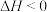 ,下列措施能加快反应速率且使平衡逆向移动的是
,下列措施能加快反应速率且使平衡逆向移动的是| A.增大压强 | B.升高温度 | C.使用催化剂 | D.充入 |
您最近一年使用:0次
2021-01-14更新
|
389次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学2020-2021学年高二上学期期末考试化学试题
20-21高二上·全国·假期作业
2 . (1)合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜,氨水)吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应的化学方程式如下:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac,如果要提高上述反应的反应速率,可以采取的措施是___________ (填字母)。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
列式计算该反应在120~180s与180~240s区间的平均反应速率___________ 、___________ ;比较两者大小可得出的结论是___________ 。
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
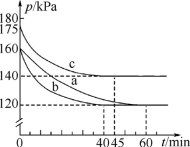
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=___________ 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b___________ ,c___________ 。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
列式计算该反应在120~180s与180~240s区间的平均反应速率
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为
您最近一年使用:0次
名校
解题方法
3 . SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
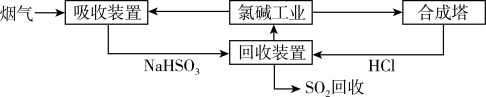
①“吸收装置”中发生反应的离子方程式是___________ 。
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________ 。
③上述流程中循环利用的物质是___________ 。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是___________ (反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。
关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________ (填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是___________ (用离子方程式及必要的文字说明)。
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用___________ (填“酸式”或“碱式”)滴定管量取试样20.00 mL,用0.10 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为___________ mol·L-1。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是
关于红褐色液体,以下是同学们的分析推测与实验。
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2  Fe(SO2) Fe(SO2)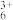 (反应b) (反应b) | ⅰ。制备Fe(OH)3胶体并检验 ⅱ。分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用
您最近一年使用:0次
4 . 下列有关说法中,正确的是
A.在 KMnO4 酸性溶液做电解质的原电池中,MnO 一定向负极移动 一定向负极移动 |
| B.常温常压下能发生自发反应的两种物质,在常温常压下一定不能大量共存 |
| C.燃烧反应一定有电子的转移,并一定伴随着能量的放出 |
| D.其他条件不变时,向平衡体系 mA(g)+nB(g)=pC(g)中加入一定量的A,A的转化率一定减小 |
您最近一年使用:0次
5 . CO(g)+Cl2(g) COCl2(g) △H<0,当反应达到平衡时,下列措施:①加压、②升温、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体,能提高CO转化率的是
COCl2(g) △H<0,当反应达到平衡时,下列措施:①加压、②升温、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体,能提高CO转化率的是
 COCl2(g) △H<0,当反应达到平衡时,下列措施:①加压、②升温、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体,能提高CO转化率的是
COCl2(g) △H<0,当反应达到平衡时,下列措施:①加压、②升温、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体,能提高CO转化率的是| A.②③ | B.③⑤ | C.①③ | D.③⑥ |
您最近一年使用:0次
2021-01-08更新
|
127次组卷
|
2卷引用:吉林省辽源市友好学校第七十届2020-2021学年高二上学期期末联考化学试题
6 . 在水溶液中,CrO 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )
 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )| A.向该溶液中滴加适量的NaHSO4固体,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大 |
| B.该反应是氧化还原反应 |
| C.向该溶液中加入过量浓NaOH溶液后,溶液呈橙色 |
| D.向体系中加入少量水,平衡逆向移动 |
您最近一年使用:0次
2021-01-06更新
|
421次组卷
|
5卷引用:安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题
安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题安徽省滁州市定远县育才学校2020-2021学年高二下学期开学考试化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2020年天津卷化学高考真题变式题1-12
名校
解题方法
7 . 钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为_______ ,若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为_____________ 。
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是_________ ,为检验处理后的浸出液中是否含有Fe3+,可选用的化学试剂是______ (填试剂名称)。
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R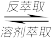 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用____
a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为_________ mol。
(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为_______________ (溶液中某离子浓度≤1×10﹣5mol•L﹣1时,认为该离子沉淀完全)。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R
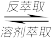 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO
 ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为
您最近一年使用:0次
名校
8 . 下列因素中一定能引起平衡移动的是
| A.催化剂 | B.温度 | C.浓度 | D.压强 |
您最近一年使用:0次
2021-01-05更新
|
294次组卷
|
5卷引用:黑龙江省哈尔滨市第三十二中学2020-2021学年高二上学期期末考试化学试题
解题方法
9 . 氨是重要的无机化工产品之一,在国民经济中占有重要的地位。液氨可直接作为氮肥外,以氨为原料可生产尿素、硝酸铁、磷酸铵等氨肥,可生产硝酸、丙烯腈等无机和有机化工产品,氨还可用作冷冻、塑料、冶金、医药、国防等工业的原料。
(1)已知N2(g)+3H2(g) 2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比
2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比 的关系如下图所示,图中T1>T2.。回答下列相关问题:
的关系如下图所示,图中T1>T2.。回答下列相关问题:

①合成氨的反应为___________ (填“吸热”或“放热”)反应。
②实验测得一定条件下合成氨反应速率方程为v=kc(N2)∙c1.5(H2)∙c-1(NH3),以下措施既能加快反应速率,又能提高H2平衡转化率的是________ (填序号)。
a.加压 b.使用催化剂 c.增大氢氮比 d.分离出NH3
③图中P点的 是
是___________ 。
④若反应容器体积为1L,测得P点反应混合气体中NH3的物质的量是 mol,T2时反应的平衡常数是
mol,T2时反应的平衡常数是___________ (保留1位小数)。
(2)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H= -905kJ/mol
4NO(g)+6H2O(g) ∆H= -905kJ/mol
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
则氮气被氧气氧化为NO的热化学方程式为___________ 。
(3)硝酸工业的尾气用NaOH溶液吸收,其中一个反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。常温下,该反应所得NaNO2溶液中 的水解平衡常数Kh=
的水解平衡常数Kh=___________ (将数据列入算式,不用算出结果),溶液中离子浓度从大到小的顺序为_______ 。(已知: HNO2的电离常数Ka=7.1×10-4)
(4)以氨为原料生产硝酸铵,根据所发生的反应,理论上用于生产硝酸的氨占总氨的___________ %。
(1)已知N2(g)+3H2(g)
 2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比
2NH3(g),平衡时NH3的物质的量分数(NH3的物质的量与全部气体物质的量的比值) n(NH3)%与氢氮比 的关系如下图所示,图中T1>T2.。回答下列相关问题:
的关系如下图所示,图中T1>T2.。回答下列相关问题:
①合成氨的反应为
②实验测得一定条件下合成氨反应速率方程为v=kc(N2)∙c1.5(H2)∙c-1(NH3),以下措施既能加快反应速率,又能提高H2平衡转化率的是
a.加压 b.使用催化剂 c.增大氢氮比 d.分离出NH3
③图中P点的
 是
是④若反应容器体积为1L,测得P点反应混合气体中NH3的物质的量是
 mol,T2时反应的平衡常数是
mol,T2时反应的平衡常数是(2)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下反应:
①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ∆H= -905kJ/mol
4NO(g)+6H2O(g) ∆H= -905kJ/mol②4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol
2N2(g)+6H2O(g) ∆H=- 1268kJ/ mol则氮气被氧气氧化为NO的热化学方程式为
(3)硝酸工业的尾气用NaOH溶液吸收,其中一个反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。常温下,该反应所得NaNO2溶液中
 的水解平衡常数Kh=
的水解平衡常数Kh=(4)以氨为原料生产硝酸铵,根据所发生的反应,理论上用于生产硝酸的氨占总氨的
您最近一年使用:0次
10 . 下列事实不能用勒夏特列原理解释的是
A.对于平衡 +H2O +H2O 2 2 +2H+,当加入NaOH溶液后黄色变深 +2H+,当加入NaOH溶液后黄色变深 |
B.A(g)+B(g) 2C(g)+D(s)的反应(C有颜色),缩小体积增大压强体系颜色变深 2C(g)+D(s)的反应(C有颜色),缩小体积增大压强体系颜色变深 |
C.反应CO+NO2 CO2 +NO ∆H<0,升高温度使平衡向逆反应方向移动 CO2 +NO ∆H<0,升高温度使平衡向逆反应方向移动 |
| D.水垢中的CaSO4用饱和Na2CO3溶液处理转化为CaCO3,而后用酸去除 |
您最近一年使用:0次
2021-01-04更新
|
305次组卷
|
2卷引用:黑龙江省齐齐哈尔市2020-2021学年高二上学期期末考试化学试题



