1 . 对处于平衡状态的反应2H2S(g) 2H2(g)+S2(g)H>0,以下说法合理的是
2H2(g)+S2(g)H>0,以下说法合理的是
 2H2(g)+S2(g)H>0,以下说法合理的是
2H2(g)+S2(g)H>0,以下说法合理的是| A.加入催化剂,反应途径将发生改变,H也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,正反应速率降低 |
| D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |
您最近一年使用:0次
2 . 在一个2L的恒容密闭容器中,加入3molA和1molB发生如下反应:3A(g)+B(g) 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是___ 反应(填“吸热”或“放热”),D的状态是__ (填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为___ ,此温度下的平衡常数K=__ (保留两位小数)。
(3)若加入适量B,则A的转化率将__ (填“增大”“减小”或“不变”,下同),化学平衡常数将__ 。
 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)达到平衡时,A的转化率为
(3)若加入适量B,则A的转化率将
您最近一年使用:0次
3 . 氯化亚铜,化学式CuCl或Cu2Cl2。为白色立方结晶或白色粉末,微溶于水,溶于浓盐酸生成氯化亚铜酸(HCuCl2强酸),溶于氨水生成氯化二氨合亚铜,不溶于乙醇。
实验室制备氯化亚铜∶
方法1∶CuCl2溶于浓盐酸,加入铜屑并加热,生成HCuCl2溶液,加水稀释可得CuCl沉淀;
方法2∶向含有铜丝、氯化铵、盐酸的溶液中加入硝酸作催化剂,通入氧气并加热,将反应得到的NH4[CuCl2]用大量的水稀释可得CuCl沉淀。
工业制法∶向CuSO4和NaCl的混合溶液中加入Fe粉或通入SO2,充分反应后再用大量的水稀释,过滤、酒精洗涤、真空干燥。
下列说法不正确的是
实验室制备氯化亚铜∶
方法1∶CuCl2溶于浓盐酸,加入铜屑并加热,生成HCuCl2溶液,加水稀释可得CuCl沉淀;
方法2∶向含有铜丝、氯化铵、盐酸的溶液中加入硝酸作催化剂,通入氧气并加热,将反应得到的NH4[CuCl2]用大量的水稀释可得CuCl沉淀。
工业制法∶向CuSO4和NaCl的混合溶液中加入Fe粉或通入SO2,充分反应后再用大量的水稀释,过滤、酒精洗涤、真空干燥。
下列说法不正确的是
| A.方法2中生成NH4[CuCl2],1mol[CuCl2]-含σ键数2mol |
| B.方法2中制备1molCuCl,参加反应氧气的体积为5.6L |
C.[CuCl2]-(aq) CuCl(s)+Cl-(aq),加水稀释,有利于CuCl沉淀生成 CuCl(s)+Cl-(aq),加水稀释,有利于CuCl沉淀生成 |
| D.用酒精洗涤CuCl沉淀,真空干燥可有效防止CuCl被空气中氧气氧化 |
您最近一年使用:0次
名校
4 . (1)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ的热量。写出该反应的热化学方程式_______ 。
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为_______ 。
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为_______ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是____ ;bc过程中改变的条件可能是_____ 。
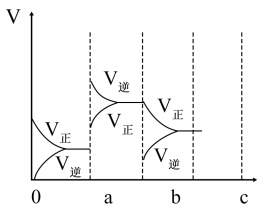
(2)若25℃,101 kPa下,1 g CH4完全燃烧生成液态水和CO2气体,放出55.6 kJ的热量,则甲烷的燃烧热为
(3)对于下列反应:2SO2(g)+ O2(g)⇌2SO3(g),如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(4)下图表示在密闭容器中反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是

您最近一年使用:0次
名校
解题方法
5 . 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。

(1)还原沉淀法是处理含Cr2O 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
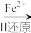 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①若平衡体系的pH=0,该溶液显___________ 色。
②根据2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为___________ ,图中右侧电极连接电源的___________ 极,其电极反应式为___________ 。
③第Ⅱ步反应的离子方程式:___________ 。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□_______

(1)还原沉淀法是处理含Cr2O
 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
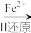 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第Ⅰ步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①若平衡体系的pH=0,该溶液显
②根据2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为③第Ⅱ步反应的离子方程式:
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□
您最近一年使用:0次
解题方法
6 . 反应 I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
(1)该温度下,该反应的化学平衡常数 K=___________ 。
(2)相同温度下,按以下初始浓度进行实验:
① 反应向__________ 方向(填“正反应”或者“逆反应”)进行,结合计算说明理由:___________ 。
②该反应达到平衡时,容器中c(HI)=___________ mmol•L-1,I2 的转化率是___________ 。
 2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)
2HI(g)在密闭容器中达到平衡时,测得:c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.77mmol•L-1。(1mmol•L-1=10-3mol•L-1)(1)该温度下,该反应的化学平衡常数 K=
(2)相同温度下,按以下初始浓度进行实验:
| 物质 | 初始浓度 |
| c(I2)/mmol•L-1 | 1.00 |
| c(H2)/mmol•L-1 | 1.00 |
| c(HI)/mmol•L-1 | 1.00 |
②该反应达到平衡时,容器中c(HI)=
您最近一年使用:0次
名校
7 . 若反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-373.4kJ·mol-1(汽车尾气净化反应之一)在恒容密闭容器中达到平衡状态,以下说法不正确的是
N2(g)+2CO2(g) ΔH=-373.4kJ·mol-1(汽车尾气净化反应之一)在恒容密闭容器中达到平衡状态,以下说法不正确的是
 N2(g)+2CO2(g) ΔH=-373.4kJ·mol-1(汽车尾气净化反应之一)在恒容密闭容器中达到平衡状态,以下说法不正确的是
N2(g)+2CO2(g) ΔH=-373.4kJ·mol-1(汽车尾气净化反应之一)在恒容密闭容器中达到平衡状态,以下说法不正确的是| A.及时分离出 CO2,使 Q 减小,Q<K,因此平衡正向移动 |
| B.及时分离出 N2,使 Q 减小,Q<K,因此平衡正向移动 |
| C.降低温度,使 Q 减小,Q<K,因此平衡正向移动 |
| D.加入催化剂可增大反应速率,从而增大一段时间内的反应物转化率 |
您最近一年使用:0次
2021-02-20更新
|
240次组卷
|
4卷引用:北京市昌平区2020-2021学年高二上学期期末考试化学试题
8 . 对于反应:  (g)+ I2(g)
(g)+ I2(g) 
 (g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
(g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
 (g)+ I2(g)
(g)+ I2(g) 
 (g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
(g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有| A.恒压条件下通入惰性气体 | B.降低温度 |
| C.增大环戊烯浓度 | D.将容器体积减小到原来的一半 |
您最近一年使用:0次
名校
9 . 为减少碳的排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下列有关说法不正确的是
CH3OH(g)+H2O(g)。下列有关说法不正确的是
 CH3OH(g)+H2O(g)。下列有关说法不正确的是
CH3OH(g)+H2O(g)。下列有关说法不正确的是| A.恒温恒容下,该反应达到平衡时,各物质的物质的量分别为1mol、3mol、1mol和1mol,若此时各物质的物质的量分别增加1mol,平衡正向移动。 |
| B.恒温恒压下,该反应达到平衡时,各物质的物质的量分别为1mol、1mol、1mol和1mol,若此时通入12molCO2,平衡正向移动 |
| C.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡物质的量逐渐增加 |
| D.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡体积分数先增大后减小 |
您最近一年使用:0次
2021-02-08更新
|
244次组卷
|
2卷引用:江西省永丰县永丰中学2020-2021学年高二上学期期中考试化学试题
名校
10 . 下列事实不能用勒夏特列原理来解释的是
| A.含酚酞的氨水溶液,微热后红色变深 |
| B.向新制氯水中加入适量硝酸银固体,溶液颜色变浅 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| D.H2(g)、Br2(g)和HBr(g)组成的平衡体系加压后颜色变深 |
您最近一年使用:0次



