1 . 下列事实不能用勒夏特列原理解释的是
| A.100℃时,纯水的pH≈6 |
| B.实验室常用排饱和食盐水的方法收集氯气 |
| C.实验室用过氧化氢制取氧气时,常常加入MnO2固体 |
| D.工业上采用高压条件合成氨气 |
您最近一年使用:0次
名校
2 . 下列事实中,不能用化学平衡移动原理解释的是有
A. 溶液中加入固体 溶液中加入固体 后颜色变深 后颜色变深 | B.氯水宜在低温、避光条件下保存 |
C.在 催化氧化成 催化氧化成 的反应中,常通入过量的空气 的反应中,常通入过量的空气 | D.将硫铁矿粉碎后再燃烧 |
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。
(黄色)+2H+。
②Cr3+(绿色)
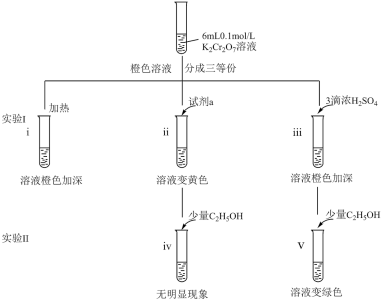
(1)i可证明反应Cr2O +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是___ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是______ 。
(3)iii的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验是否能达到预期目的____ (填“能”或“不能”),理由是_______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是_____ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。
(黄色)+2H+。②Cr3+(绿色)

(1)i可证明反应Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)iii的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验是否能达到预期目的
(4)根据实验Ⅱ中不同现象,可以得出的结论是
您最近一年使用:0次
名校
4 . 重铬酸钾(K2Cr2O7)又名红矾钾,是化学实验室中的一种重要分析试剂,在工业上用途广泛。已知K2Cr2O7溶液中存在平衡:
请回答下列问题:
(1)K2Cr2O7溶液中反应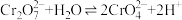 平衡常数的表达式为
平衡常数的表达式为
___________ 。
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是___________ 。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7___________ K2Cr2O7(填“>”“<”或“=”)。
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)

(ⅱ)

①下列有关K2Cr2O7溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时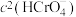 与
与 的比值保持不变
的比值保持不变
②在0.10 mol⋅L-1 K2Cr2O7溶液中设 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为_______ =0.10。
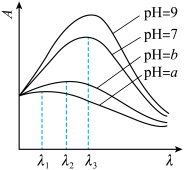
③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(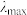 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的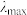 最接近的是
最接近的是_______ ;溶液pH从a变到b的过程中, 的值
的值_______ (填“增大”“减小”或“不变”)。

请回答下列问题:
(1)K2Cr2O7溶液中反应
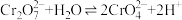 平衡常数的表达式为
平衡常数的表达式为
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)


(ⅱ)



①下列有关K2Cr2O7溶液的说法正确的有
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
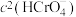 与
与 的比值保持不变
的比值保持不变②在0.10 mol⋅L-1 K2Cr2O7溶液中设
 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(
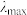 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的 最接近的是
最接近的是 的值
的值
您最近一年使用:0次
名校
5 . 化学在日常生活和生产中有着重要的应用。下列说法不正确的是
| A.中和反应反应热的测定实验中的玻璃搅拌器换成铜制搅拌器效果更好 |
| B.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 |
| C.工业上SO2催化氧化制取SO3时,适当增大氧气浓度可以增大SO2的平衡转化率 |
| D.配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解 |
您最近一年使用:0次
名校
6 . Ⅰ.在硫酸工业中,通过下列反应使SO2转化为SO3:其中一步反应为2SO2(g)+O2(g)  2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。
(1)利用下表实验数据回答问题:
①应选择的温度是___________ 。
②应采用的压强是___________ ,理由是___________ 。
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是___________ 。
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
(2)①该温度下此反应的化学平衡常数为K=___________ 。
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)___________ v(逆) (填“>”、“<”或“=”)。
Ⅲ.下图表示在密闭容器中反应:2SO2+O2 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
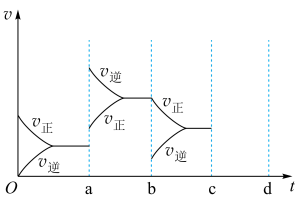
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)________ 。
 2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。(1)利用下表实验数据回答问题:
| 温度 | 平衡时SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②应采用的压强是
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g)
 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。(2)①该温度下此反应的化学平衡常数为K=
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)
Ⅲ.下图表示在密闭容器中反应:2SO2+O2
 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)
您最近一年使用:0次
名校
7 . 下列工业生产中采用的措施与目的相符合的是
| A.石油是重要的化工原料,其分馏的目的是为了获得乙烯、丙烯等短链不饱和烃 |
| B.SO2接触法制SO3在高温条件下进行,以提高SO3产率 |
| C.合成氨工业中原料气必须经过净化,以防止催化剂中毒 |
| D.海带提碘时通过浓缩提高碘离子浓度,以减少氧化剂的用量 |
您最近一年使用:0次
解题方法
8 . “碳达峰、碳中和”是我国社会发展重大战略之一, 的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用
的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用 的方法。
的方法。
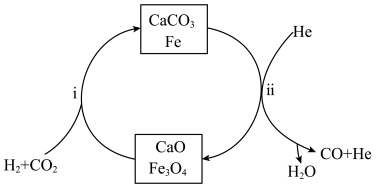
方法I: 加氢制备合成气
加氢制备合成气
在一定温度、压强为 条件下,
条件下, 和
和 按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
相关化学键的键能数据如下表:
(1)该反应的热化学方程式为
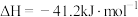 ,则
,则
______ 。
(2)有关该反应的说法错误的是_______(填标号)。
(3)反应i达到平衡后通入 ,有利于反应ii的进行,结合平衡移动原理,解释原因
,有利于反应ii的进行,结合平衡移动原理,解释原因_____________________________________________ 。
方法II: 重整制备合成气
重整制备合成气
 重整制备合成气时发生的反应主要有:
重整制备合成气时发生的反应主要有:
主反应:

副反应: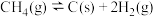
(4)在一定条件下,向 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
__________ 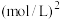 。
。
(5)主反应的反应速率 ,
, ,
, 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (Ea为活化能、T为温度,R、C为常数),实验测得
(Ea为活化能、T为温度,R、C为常数),实验测得 的实验数据如图所示,则该反应正反应的活化能为
的实验数据如图所示,则该反应正反应的活化能为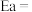
________  ,升高温度时,
,升高温度时,
_____ (填“增大”、“减小”或“不变”)。
(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为__________ , 的值
的值__________ (填“增大”、“减小”或“不变”)。
 的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用
的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用 的方法。
的方法。方法I:
 加氢制备合成气
加氢制备合成气在一定温度、压强为
 条件下,
条件下, 和
和 按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。相关化学键的键能数据如下表:

化学键 |
|
|
|
|
键能E/( | 745 | a | 1046 | 436 |
(1)该反应的热化学方程式为

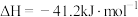 ,则
,则
(2)有关该反应的说法错误的是_______(填标号)。
| A.当装置内的气体压强不变时,反应达到平衡状态 |
B.若在反应中能及时分离出 ,可以提高 ,可以提高 的转化率 的转化率 |
C.反应ii的总反应为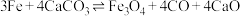 |
D.选择合适的催化剂会提高平衡时 的产率 的产率 |
(3)反应i达到平衡后通入
 ,有利于反应ii的进行,结合平衡移动原理,解释原因
,有利于反应ii的进行,结合平衡移动原理,解释原因方法II:
 重整制备合成气
重整制备合成气 重整制备合成气时发生的反应主要有:
重整制备合成气时发生的反应主要有:主反应:


副反应:
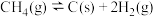
(4)在一定条件下,向
 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
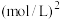 。
。(5)主反应的反应速率
 ,
, ,
, 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (Ea为活化能、T为温度,R、C为常数),实验测得
(Ea为活化能、T为温度,R、C为常数),实验测得 的实验数据如图所示,则该反应正反应的活化能为
的实验数据如图所示,则该反应正反应的活化能为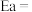
 ,升高温度时,
,升高温度时,

(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为
 的值
的值
您最近一年使用:0次
名校
9 . 氯水中存在平衡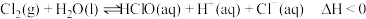 ,下列说法正确的是
,下列说法正确的是
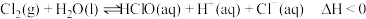 ,下列说法正确的是
,下列说法正确的是A.升高温度,氯水中的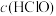 增大 增大 |
| B.氯水中加入少量醋酸钠固体,平衡不发生移动 |
C.该平衡可解释用饱和食盐水除去氯气中混有的 气体的原因 气体的原因 |
D.取两份氯水,分别滴加 溶液和淀粉 溶液和淀粉 溶液,若前者产生白色沉淀,后者溶液变蓝色,可以证明上述反应为可逆反应 溶液,若前者产生白色沉淀,后者溶液变蓝色,可以证明上述反应为可逆反应 |
您最近一年使用:0次
名校
10 . 密闭容器内的可逆反应 达到平衡状态时,保持恒温恒容,向容器中加入一定量的
达到平衡状态时,保持恒温恒容,向容器中加入一定量的 ,下列说法正确的是
,下列说法正确的是
 达到平衡状态时,保持恒温恒容,向容器中加入一定量的
达到平衡状态时,保持恒温恒容,向容器中加入一定量的 ,下列说法正确的是
,下列说法正确的是A.平衡正向移动, 转化率增大 转化率增大 | B.浓度商Q变小,平衡常数K变大 |
C.正反应速率增大, 转化率增大 转化率增大 | D.逆反应速率减小,平衡常数K不变 |
您最近一年使用:0次





 )
)

