1 . 已知:[Co( H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2- 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下: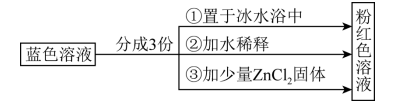
| A.由实验①可推知正反应为放热反应 |
| B.等物质的量的 [Co( H2O)6]2+和 [CoCl4]2-中σ键数之比为 9:2 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2- |
您最近半年使用:0次
2024-03-24更新
|
50次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高二下学期第一次月考化学试题
解题方法
2 . 下列操作能达到相应实验目的的是

A.除去乙烯中的少量 | B.研究浓度对化学平衡的影响 |
| C.除去二氧化锰中的少量氯酸钾 | D.用氢氧化钠溶液滴定盐酸 |
您最近半年使用:0次
解题方法
3 . 下列叙述与对应的图示相符合的是
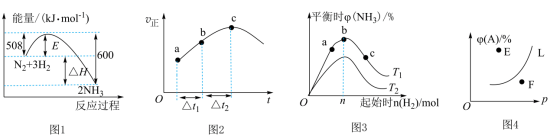

A.图1为 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 左右合成氨比室温更有利 左右合成氨比室温更有利 |
B.图2为在绝热恒容密闭容器中通入 和 和 ,反应 ,反应 的 的 图,由图可知该反应为放热反应 图,由图可知该反应为放热反应 |
C.图3为合成氨反应中,保持其他条件不变,起始时 用量、反应温度对反应的影响图,则图中温度 用量、反应温度对反应的影响图,则图中温度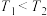 , , 、 、 、 、 三点均处于平衡状态,反应物 三点均处于平衡状态,反应物 的平衡转化率:a<b<c 的平衡转化率:a<b<c |
D.图4为反应 平衡时 平衡时 的体积分数与反应压强的关系图,则 的体积分数与反应压强的关系图,则 点: 点: |
您最近半年使用:0次
4 . 下列能用勒夏特列原理解释的是
| A.及时分离出氨有利于提高氨的产量 |
| B.H2、I2、HI平衡时的混合气体加压后颜色变深 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.红棕色的NO2加压后颜色先变深后变浅 |
您最近半年使用:0次
2024-03-21更新
|
23次组卷
|
2卷引用:海南省三亚市2023-2024学年鲁迅中学高二上学期化学期中测试
名校
5 . 向恒温恒容密闭容器中通入 和
和 ,反应
,反应 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是
,达到新平衡时,下列有关判断错误的是
 和
和 ,反应
,反应 达到平衡后,再通入一定量
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是
,达到新平衡时,下列有关判断错误的是A. 的平衡浓度增大 的平衡浓度增大 | B.反应平衡常数增大 |
| C.逆向反应速率减小 | D. 的转化总量增大 的转化总量增大 |
您最近半年使用:0次
2024-02-14更新
|
69次组卷
|
2卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
2023高三·全国·专题练习
6 . 萨巴蒂尔反应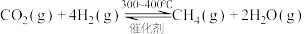 ,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
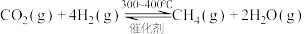 ,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是
,与水的电解联合使用是一种重要的载人航天器中氧气再生的方法。下列说法不正确的是A.上述反应 >0 >0 |
B.增大 , , 的平衡转化率升高 的平衡转化率升高 |
C.上述反应平衡常数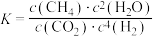 |
D.萨巴蒂尔反应产生的 可作航天器燃料 可作航天器燃料 |
您最近半年使用:0次
7 . 根据下列实验操作及现象所得出的结论或解释正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | FeCl3+3KSCN⇌Fe(SCN)3+3KCl在平衡体系中加入KCl晶体 | 溶液颜色不变 | 加入少量KCl晶体,不会影响该化学平衡 |
| B | 取相同大小、形状和质量的Cu粒分别投入稀硝酸和浓硝酸中 | Cu粒与浓硝酸反应更剧烈 | 实验目的是探究浓度对化学反应速率的影响 |
| C | 相同的铝片分别与同温同体积且c(H+)=1 mol·L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| D | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液放出的氢气较多 | HX的酸性比HY强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
8 . 某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: ΔH=+13.8kJ/mol ΔH=+13.8kJ/mol | |
步骤: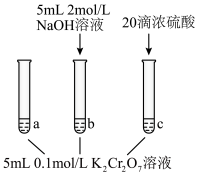 | 现象:待试管b中颜色不变后与试管a比较,溶液颜色变浅。 滴加浓硫酸、试管c温度略有升高,溶液颜色与试管a相比,变深。 |
| A.该实验不能证明减小生成物浓度,平衡正向移动 |
B.待试管b中溶液颜色不变的目的是使 完全反应 完全反应 |
| C.该反应是一个氧化还原反应 |
D.试管c中的现象说明影响平衡的主要因素是 浓度 浓度 |
您最近半年使用:0次
2023高三·全国·专题练习
9 . 25℃,向40mL0.05mol/L的FeCl3溶液中加入10mL0.15mol/L的KSCN溶液,发生反应:Fe3++3SCN- Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
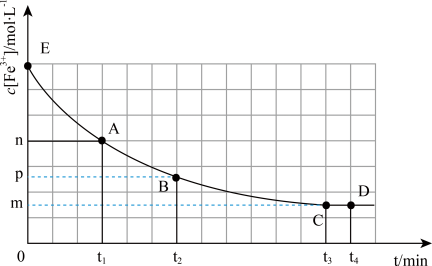
 Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示(盐类的水解影响可忽略不计)。下列说法正确的是
| A.在该反应过程中,A点的正反应速率小于B点的逆反应速率 |
| B.E点对应的坐标为(0,0.04) |
C.该反应的平衡常数K=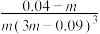 |
| D.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动 |
您最近半年使用:0次
解题方法
10 . 一定条件下,1-苯基丙炔(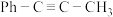 )可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
)可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
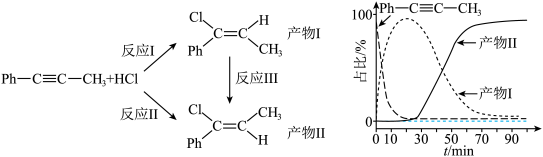
下列说法错误的是
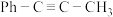 )可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
)可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
下列说法错误的是
| A.反应焓变:反应Ⅰ>反应Ⅱ |
| B.反应活化能:反应Ⅰ>反应Ⅱ |
| C.增加HCl浓度可增大平衡时产物Ⅱ和产物Ⅰ的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近半年使用:0次
2023-10-11更新
|
134次组卷
|
2卷引用:山东省潍坊市五县区2023-2024学年高三上学期10月阶段监测化学试题



