1 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度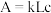 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若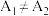 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: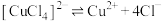 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: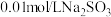 溶液,
溶液,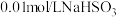 溶液,
溶液, 固体,
固体,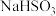 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: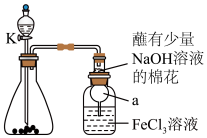
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节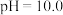 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。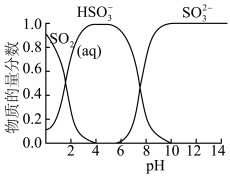
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
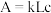 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若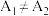 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
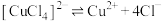 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
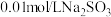 溶液,
溶液,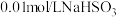 溶液,
溶液, 固体,
固体,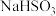 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
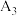 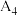 (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近一年使用:0次
2024·黑龙江·模拟预测
名校
解题方法
2 . 氢能是一种极具发展潜能的清洁能源。对于可逆反应:
 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是

 ,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
,在容积恒为2L的密闭容器中,将2.0molC0与8.0molH2混合加热到830℃发生上述反应,5min时达到平衡,CO的转化率是80%。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H2的体积分数。选用相同质量、不同粒径的CaO固体进行实验时,对比实验的结果如图所示。下列叙述中错误的是
| A.微米CaO和纳米CaO对平衡影响不同主要是CaO作为催化剂表面积越大,反应的速率越快 |
B.在生产中,增大 的用量可同时提高CO的转化率和 的用量可同时提高CO的转化率和 的产率 的产率 |
C.5min内的平均反应速率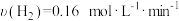 |
| D.平衡时间容器中通入He增大压强,平衡不移动 |
您最近一年使用:0次
名校
3 . 在一定温度下,向体积固定的密闭容器中加入足量 和
和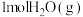 。反应平衡时,
。反应平衡时, 的转化率为
的转化率为 的物质的量为
的物质的量为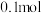 。
。
(1)下列说法正确的是___________ 。
A.将炭块粉碎,可加快反应速率
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于
(2)若平衡时向容器中充入惰性气体,容器内压强___________ (选填“增大“减小”或“不变”),反应①的
___________ (选填“增大”“减小”或“不变”),平衡___________ (选填“正向移动”“逆向移动”或“不移动”)。
 和
和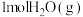 。反应平衡时,
。反应平衡时, 的转化率为
的转化率为 的物质的量为
的物质的量为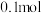 。
。(1)下列说法正确的是
A.将炭块粉碎,可加快反应速率
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于
(2)若平衡时向容器中充入惰性气体,容器内压强

您最近一年使用:0次
名校
4 . 已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图:
[CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图:
 [CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图:
[CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图: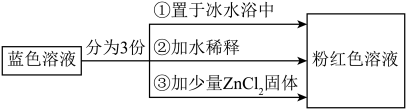
| A.由实验①可推知ΔH>0 |
| B.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中,所含配位键数目不同 |
| C.实验②是由于加水稀释,使得Q<K,导致平衡逆向移动 |
| D.由实验③可知该实验条件下配离子的稳定性:[ZnCl4]2->[CoCl4]2- |
您最近一年使用:0次
名校
5 . 下列实验目的、实验操作及现象与对应结论都正确的是
选项 | 实验目的 | 实验操作及现象 | 结论 |
A | 检验蔗糖是否水解 | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的 ,无砖红色沉淀 ,无砖红色沉淀 | 蔗糖未发生水解 |
B | 探究镁和铝的金属活泼性 | 向盛有浓 溶液的两支试管中分别加入除去氧化膜的镁带和铝片,加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 溶液的两支试管中分别加入除去氧化膜的镁带和铝片,加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 | 金属活泼性: 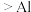 |
C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加浓硫酸,溶液黄色变为橙红色 溶液中缓慢滴加浓硫酸,溶液黄色变为橙红色 | 增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
D | 探究在相同条件下 和 和 的溶解度大小 的溶解度大小 | 向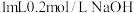 溶液中滴入2滴 溶液中滴入2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀 溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度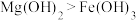 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 以CuZnOAl2O3作催化剂发生反应2CH3CHO(g)+H2O(g) C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
 C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是A.该反应的平衡常数K=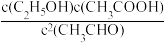 |
| B.反应物的键能总和小于生成物的键能总和 |
| C.该反应中每消耗1 mol H2O(g),转移电子数约为6.02×1023 |
| D.将C2H5OH移出一段时间后,v正增大 |
您最近一年使用:0次
2024-04-26更新
|
232次组卷
|
3卷引用:江苏省连云港高级中学2023-2024学年高三下学期4月期中考试化学试题
名校
7 . 某温度下,向VL恒容密闭容器中通入4molX(g),发生反应:① ,②
,② 。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
 ,②
,② 。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是
。反应体系中X、Y、Z的物质的量随时间t的变化曲线如图所示。下列说法错误的是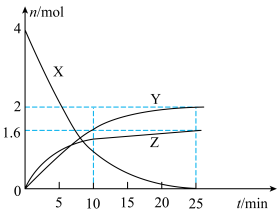
| A.25min时,生成了3.2molM |
B.0~10min内,气体X的平均反应速率为 |
C.该温度下,反应②的平衡常数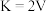 |
| D.25min时保持其他条件不变,再向体系中通入1molY(g)后,反应②的平衡不移动 |
您最近一年使用:0次
名校
8 . 氢气是重要的工业原料,煤的气化是一种重要的制氢途径。反应过程如下:
①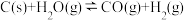 (吸热反应)
(吸热反应)
②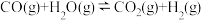 (放热反应)
(放热反应)
在一定温度下,向体积固定的密闭容器中加入足量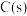 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为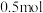 ,
, 的物质的量为
的物质的量为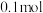 。
。
(1)下列说法错误的是___________。
(2)若要提高碳的转化率,请你再设计一种措施:___________ 。
①
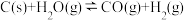 (吸热反应)
(吸热反应)②
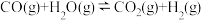 (放热反应)
(放热反应)在一定温度下,向体积固定的密闭容器中加入足量
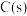 和
和 。反应平衡时,
。反应平衡时, 的物质的量为
的物质的量为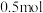 ,
, 的物质的量为
的物质的量为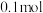 。
。(1)下列说法错误的是___________。
| A.增加炭粉,能使反应①平衡正向移动 |
| B.混合气体的密度保持不变时,说明反应体系已达到平衡 |
C.平衡时 的体积分数可能大于 的体积分数可能大于 |
D.升高温度可能增大 的转化率 的转化率 |
您最近一年使用:0次
名校
9 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: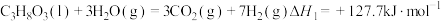
反应Ⅱ: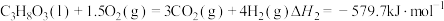
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠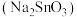 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积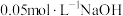 溶液和
溶液和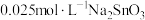 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为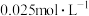 时,氢气产率接近
时,氢气产率接近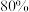 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。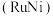 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用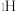 、
、 和
和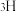 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
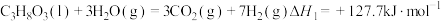
反应Ⅱ:
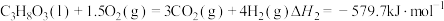
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠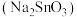 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积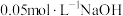 溶液和
溶液和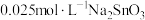 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是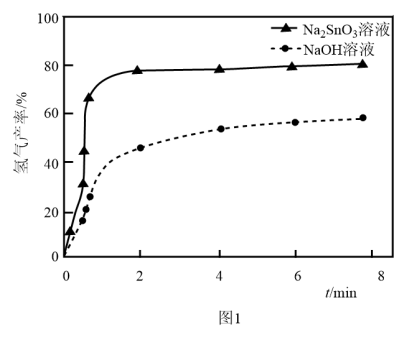
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为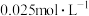 时,氢气产率接近
时,氢气产率接近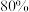 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是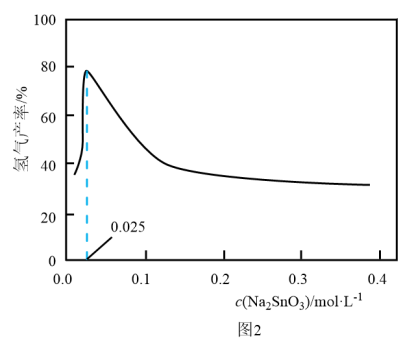
 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用 、
、 和
和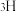 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为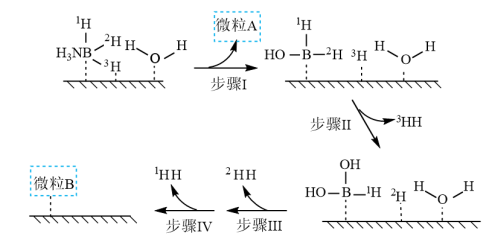
您最近一年使用:0次
名校
解题方法
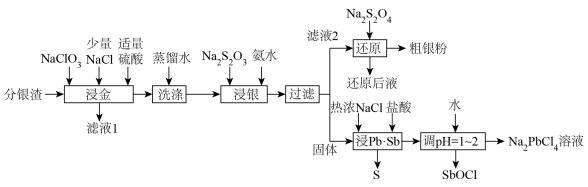
10 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近一年使用:0次

 溶液
溶液



