1 . 向两个体积可变的密闭容器中均充入1mol的A和2mol的B,发生反应:A2(g)+2B2(g)⇌2AB2(g)ΔH.维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
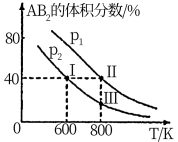
已知:①图中I、II、III点均处于曲线上;②点II时容器的体积为0.1L。下列叙述正确的是

已知:①图中I、II、III点均处于曲线上;②点II时容器的体积为0.1L。下列叙述正确的是
| A.由图象可知:p1<p2 ΔH<0 |
| B.点I时A2的平衡转化率为40% |
| C.点III所对应的反应平衡常数K=0.2 |
| D.将点II所对应的容器冷却到600K,不可能变成点I |
您最近一年使用:0次
名校
解题方法
2 . 苯乙烯是石油化学工业的重要原料之一。世界上90%以上的苯乙烯是采用乙苯催化脱氢法制得。具体反应为 (g)
(g)
 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。
(1)相关物质的相对能量如表所示:
则苯乙烯(g)的相对能量为___ kJ•mol-1。
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是___ 。
②该温度下,反应的平衡常数Kp=__ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为 (g)+H2(g)
(g)+H2(g)
 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
①对于该反应,下列说法正确的是____ 。
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则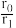 =
=___ 。
(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.
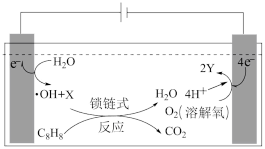
阴极反应式为____ ,X微粒的化学式为____ 。
 (g)
(g)
 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。(1)相关物质的相对能量如表所示:
| 物质 | 乙苯(g) | H2(g) |
| 相对能量/(kJ•mol-1) | a | 0 |
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是
②该温度下,反应的平衡常数Kp=
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为
 (g)+H2(g)
(g)+H2(g)
 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。①对于该反应,下列说法正确的是
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则
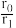 =
=(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.

阴极反应式为
您最近一年使用:0次
解题方法
3 . 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和催化剂的条件下,两容器中各自发生下列反应
 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是
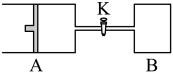

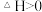 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是
| A.反应开始时,B容器中化学反应速率快 |
| B.A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C.打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) |
| D.打开K达新平衡后,升高B容器温度,A容器体积会增大 |
您最近一年使用:0次
2021-02-07更新
|
328次组卷
|
5卷引用:【浙江新东方】高中化学20210304-010
(已下线)【浙江新东方】高中化学20210304-010浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)期中考试模拟试题(一)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)四川省成都金苹果锦城第一中学2023-2024学年高二上学期期中考试化学试题
4 . 为减少碳氧化物的排放,工业上可回收 和
和 合成甲醇(
合成甲醇( )。
)。
(1)利用 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:
反应Ⅰ
反应Ⅱ
控制 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
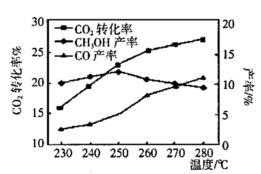
①反应Ⅰ能自发的反应条件:______ 。(填“低温”、“高温”、“任何温度”)
②由图可知温度升高 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是______ 。
③由图可知获取 最适宜的温度是
最适宜的温度是______ 。
④控制 和
和 初始投料比为
初始投料比为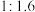 ,在
,在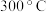 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为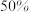 ,甲醇选择性为
,甲醇选择性为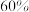 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为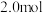 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是______ 。(甲醇的选择性:转化的 中生成甲醇的百分比)
中生成甲醇的百分比)
(2)利用 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:
反应Ⅲ
其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是______ 。
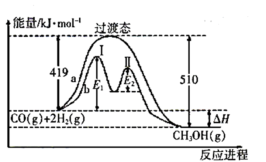
A. 上述反应的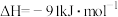
B. 反应正反应的活化能为
反应正反应的活化能为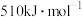
C. 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D. 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E. 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入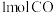 和
和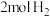 ,向乙中加入
,向乙中加入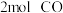 和
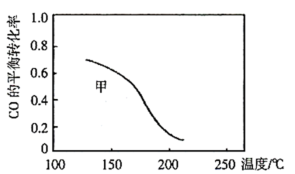
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线______ 。
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式______ 。
 和
和 合成甲醇(
合成甲醇( )。
)。(1)利用
 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:反应Ⅰ

反应Ⅱ

控制
 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
①反应Ⅰ能自发的反应条件:
②由图可知温度升高
 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是③由图可知获取
 最适宜的温度是
最适宜的温度是④控制
 和
和 初始投料比为
初始投料比为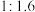 ,在
,在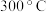 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为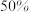 ,甲醇选择性为
,甲醇选择性为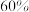 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为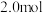 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是 中生成甲醇的百分比)
中生成甲醇的百分比)(2)利用
 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:反应Ⅲ

其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是

A. 上述反应的
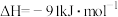
B.
 反应正反应的活化能为
反应正反应的活化能为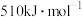
C.
 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应D.
 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E.
 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入
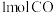 和
和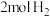 ,向乙中加入
,向乙中加入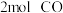 和
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式
您最近一年使用:0次
名校
解题方法
5 . 利用辉钼矿冶炼组的原理为
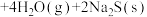
 。在压强为
。在压强为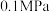 的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:

下列判断正确的是

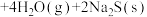
 。在压强为
。在压强为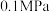 的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
下列判断正确的是
A.通过图象曲线变化规律无法判断 正负 正负 |
| B.a为CO变化曲线,b为水蒸气变化曲线 |
C.压强为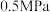 时,虚线Ⅱ可能为 时,虚线Ⅱ可能为 的变化曲线 的变化曲线 |
D.M点 的转化率为75% 的转化率为75% |
您最近一年使用:0次
2021-01-26更新
|
684次组卷
|
8卷引用:重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题
重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题吉林省长春市十一高中2022届高三上学期第一学程考试化学试题山西省运城市2020-2021学年高二上学期期末考试化学试题(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)湖南省攸县长鸿实验中学2022-2023学年高三第四次月考化学试题(已下线)第4讲 化学反应速率及平衡图像
解题方法
6 . 向绝热恒容密闭容器中通入一定量的SO2和NO2,一定条件下发生反应: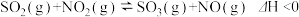 ,测得SO3浓度随时间变化如下所示,下列说法正确的是
,测得SO3浓度随时间变化如下所示,下列说法正确的是
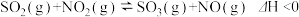 ,测得SO3浓度随时间变化如下所示,下列说法正确的是
,测得SO3浓度随时间变化如下所示,下列说法正确的是| 反应时间/s | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
| SO3浓度/mol/L | 0.10 | 0.14 | 0.21 | 0.26 | 0.30 | 0.32 | 0.33 | 0.33 |
| A.50s时,SO3的生成速率为0.0028mol·L-1·s-1 |
| B.40~90s的逆反应速率逐渐增大 |
| C.40~50s的反应速率大于70~80s的反应速率 |
| D.110s时,缩小容器体积再次达到平衡后,SO2的转化率和浓度均保持不变 |
您最近一年使用:0次
2020-12-10更新
|
285次组卷
|
2卷引用:内蒙古北京四中呼和浩特分校2021-2022学年高二上学期第一次月考化学试题
名校
7 . 只知某反应向正反应方向移动,下列说法不正确 的是
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
| A.只有①② | B.只有①②③ | C.只有③④ | D.①②③④ |
您最近一年使用:0次
2020-11-23更新
|
597次组卷
|
6卷引用:浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题
浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)黑龙江省龙西北八校联合体2022-2023学年高二上学期第一次月考化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题浙江省东阳中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
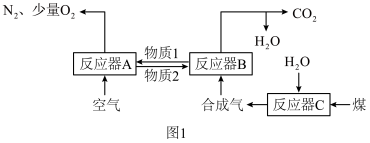
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
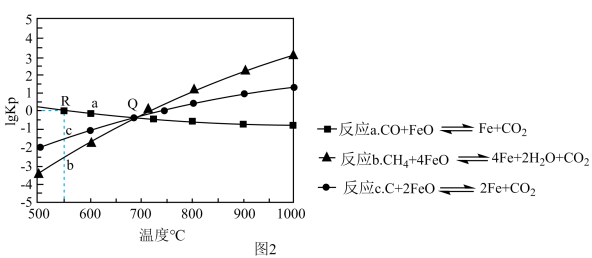
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
295次组卷
|
5卷引用:新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题
名校
9 . 一定温度下将CaCO3放入密闭真空容器中,反应CaCO3(s) CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
 CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是| A.平衡向左移动 | B.压强不变 |
| C.平衡常数不变 | D.固体总质量不变 |
您最近一年使用:0次
2020-04-28更新
|
300次组卷
|
4卷引用:【浙江新东方】高中化学20210513-044【2021】【高二下】
(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题山东省日照市2018-2019学年高二上学期期末模块考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01
名校
解题方法
10 . 研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=____ kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。
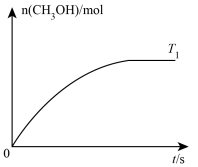
①下列条件可以判定反应到达平衡状态的是____ (填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。
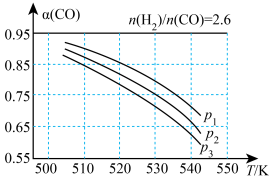
①α(CO)随温度升高而减小的原因是____ 。
②图中压强p1、p2、p3中最大的是____ 。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____ 。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。

反应Ⅰ CO(g)+2H2(g)
 CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1反应Ⅱ CO2(g)+H2(g)
 CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的ΔH=
CH3OH(g)+H2O(g)的ΔH=(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。

①下列条件可以判定反应到达平衡状态的是
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。

①α(CO)随温度升高而减小的原因是
②图中压强p1、p2、p3中最大的是
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

您最近一年使用:0次
2020-01-01更新
|
173次组卷
|
2卷引用:江苏省苏州实验中学2020--2021学年高二下学期5月份学情调研考试化学试题



