1 . 已知: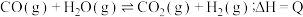 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
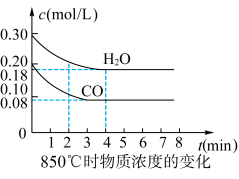
(2) 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率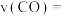
___________ 。
(3)若在 时进行,且
时进行,且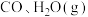 的起始浓度均为
的起始浓度均为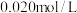 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
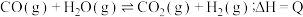 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率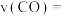

(3)若在
 时进行,且
时进行,且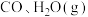 的起始浓度均为
的起始浓度均为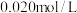 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
名校
2 . 反应: ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时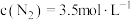 ,
,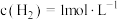 ,
,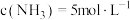 ,求:
,求:
(1) 和
和 的起始浓度
的起始浓度_________ 。
(2) 的转化率
的转化率_________ 。
(3)平衡时压强为开始时压强的百分之几_________ 。
(4)平衡时 占总体积的体积分数
占总体积的体积分数_________ 。
 ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时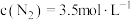 ,
,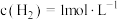 ,
,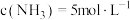 ,求:
,求:(1)
 和
和 的起始浓度
的起始浓度(2)
 的转化率
的转化率(3)平衡时压强为开始时压强的百分之几
(4)平衡时
 占总体积的体积分数
占总体积的体积分数
您最近一年使用:0次
名校
3 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: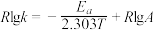 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能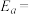
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
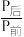 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: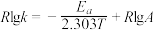 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
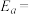

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
432次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷
名校
4 .  与
与 在高温下发生反应:
在高温下发生反应: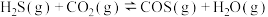
 。在
。在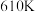 时,将
时,将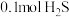 与
与 充入
充入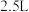 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
(1)求 的平衡转化率
的平衡转化率_______ 。
(2)求该温度下的反应平衡常数_______ 。
 与
与 在高温下发生反应:
在高温下发生反应: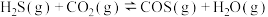
 。在
。在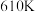 时,将
时,将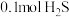 与
与 充入
充入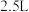 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。(1)求
 的平衡转化率
的平衡转化率(2)求该温度下的反应平衡常数
您最近一年使用:0次
名校
解题方法
5 . 依据水溶液中的平衡相关原理,回答下列问题:
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是___________ mol∙L-1。
②计算此温度下HA的电离平衡常数Ka约为___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法正确的是___________。(填选项)
(3)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=2的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是___________ 。在纯碱溶液中下列关系成立的是___________
A.c(H+)+c(Na+)=c( )+c(
)+c( )+c(OH-)
)+c(OH-)
B.c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(OH-)-c(H+)= c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c( )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是
②计算此温度下HA的电离平衡常数Ka约为
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=4.0×10-8 |
以下说法正确的是___________。(填选项)
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.25℃时NaClO的水解平衡常数约为2.5×10-7 |
| C.表中三种酸,酸性最强的是CH3COOH |
D.向NaClO溶液中通入少量CO2气体,可以发生反应:2ClO-+H2O+CO2==2HClO+ |
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
A.c(H+)+c(Na+)=c(
 )+c(
)+c( )+c(OH-)
)+c(OH-) B.c(
 )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)C.c(OH-)-c(H+)= c(
 )+2c(H2CO3)
)+2c(H2CO3)D.c(Na+)=c(
 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
您最近一年使用:0次
6 . 运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式______ 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①400℃时,2NH3(g) N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正______ v(N2)逆(填“>”“<”“=”或“不能确定”)。
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡______ 移动(填“向左”、“向右”或“不”);反应的∆H______ (填“增大”、“减小”或“不变”)。
(3)水煤气转化反应CO(g)+H2O(g) CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
①平衡常数K(650℃)______ K(900℃)(填“大于”,“小于”或“等于”)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为______ 。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。①400℃时,2NH3(g)
 N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡
(3)水煤气转化反应CO(g)+H2O(g)
 CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:| 实验编号 | 温度/℃ | 起始量)/mol | 平衡量)/mol | 达到平衡所需时间)/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①平衡常数K(650℃)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为
您最近一年使用:0次
解题方法
7 . 完成下列填空
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。
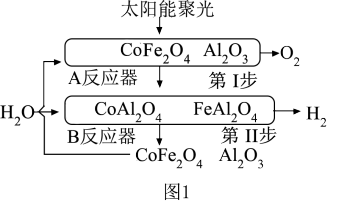
第Ⅰ步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1
第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g) CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=_______ g·min-1(保留2位小数)。a点时,v正∶v逆=_______ (填最简整数比)。

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=_______ 。
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。

第Ⅰ步:CoFe2O4(s)+3Al2O3(s)
 CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g)
 CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)在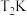 、
、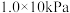 下,等物质的量的CO与
下,等物质的量的CO与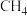 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,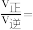
_______ 。
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,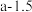 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K=_______  。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将_______ , 的体积分数将
的体积分数将_______ (填“增大”“减小”或“不变”)。

(3)反应 的反应机理如下:
的反应机理如下:
①第一步: (快速平衡)
(快速平衡)
第二步: (快速平衡)
(快速平衡)
第三步: (慢反应)
(慢反应)
②只需一步完成的反应称为基元反应,基元反应如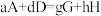 的速率方程,
的速率方程,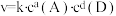 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成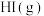 的速率方程为v=
的速率方程为v=_______  (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。
(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的,催化氧化:
的,催化氧化:
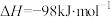 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%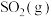 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(1)在
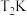 、
、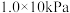 下,等物质的量的CO与
下,等物质的量的CO与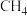 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,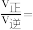
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,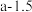 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K= 。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将 的体积分数将
的体积分数将
(3)反应
 的反应机理如下:
的反应机理如下:①第一步:
 (快速平衡)
(快速平衡)第二步:
 (快速平衡)
(快速平衡)第三步:
 (慢反应)
(慢反应)②只需一步完成的反应称为基元反应,基元反应如
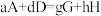 的速率方程,
的速率方程,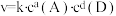 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成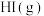 的速率方程为v=
的速率方程为v= (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是
 的,催化氧化:
的,催化氧化:
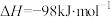 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%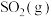 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
您最近一年使用:0次
名校
解题方法
9 .  超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。
(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。

a点所代表的状态_______ (填“是”或“不是”)平衡状态;b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
(2)恒温恒容刚性密闭容器中, 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。
①研究表明CO的生成速率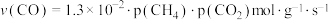 ,某时刻测得
,某时刻测得 ,则
,则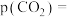
_______ kPa,
_______  。
。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式 为
_______  。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
 超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应
 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
a点所代表的状态
 的转化率高于c点,原因是
的转化率高于c点,原因是(2)恒温恒容刚性密闭容器中,
 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。①研究表明CO的生成速率
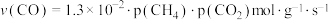 ,某时刻测得
,某时刻测得 ,则
,则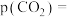

 。
。②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的

 。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
您最近一年使用:0次
2022-10-09更新
|
320次组卷
|
2卷引用:湖南省常德市临澧县第一中学2022-2023学年高二上学期第一次阶段性考试化学试题
名校
解题方法
10 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: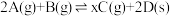 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
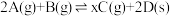 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题
江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题



