名校
解题方法
1 . 为探究Ag+与Fe3+氧化性的相关问题,甲乙两位同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g、Ag2SO4:0.796g
(1)甲同学的实验如表:
注:经检验黑色固体为Ag
①甲同学得出 氧化性强于
氧化性强于 的依据是
的依据是___ 。
②Ag+氧化Fe2+的离子方程式为:___ 。
(2)乙同学采用如图的电化学装置进行验证。补全电化学装置示意图___ 。
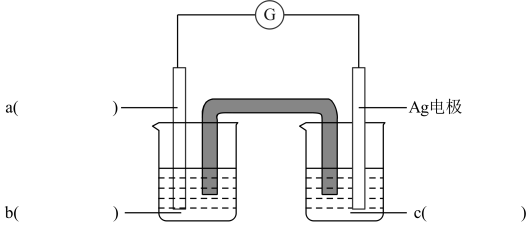
实验中,乙同学发现电流计指针为0后,继续向左侧烧杯中加入___ 溶液,Ag电极溶解,指针反向偏转,说明Ag+氧化Fe2+的反应是可逆反应。
(3)丙同学设计了如下实验测定上述可逆反应的平衡常数K。
实验II:一定温度下,将0.0100mol·L-1Ag2SO4溶液与0.0400mol/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀;
实验III:待实验II中反应达到平衡状态时,取vmL上层清液,用c1mol/LKSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2++(红色) K2=102.3
FeSCN2++(红色) K2=102.3
①滴定过程中Fe3+的作用是____ 。
②测得平衡常数K=____ 。(用含c1,v1,v的代数式表示)
③取实验II的浊液测定c(Ag+),会使所测K值____ (填“偏高”“偏低”或“不受影响”。
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g、Ag2SO4:0.796g
(1)甲同学的实验如表:
| 序号 | 操作 | 现象 |
| 实验I | 将2mL1mol/LAgNO3溶液加入到1mL1mol/LFeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①甲同学得出
 氧化性强于
氧化性强于 的依据是
的依据是②Ag+氧化Fe2+的离子方程式为:
(2)乙同学采用如图的电化学装置进行验证。补全电化学装置示意图

实验中,乙同学发现电流计指针为0后,继续向左侧烧杯中加入
(3)丙同学设计了如下实验测定上述可逆反应的平衡常数K。
实验II:一定温度下,将0.0100mol·L-1Ag2SO4溶液与0.0400mol/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀;
实验III:待实验II中反应达到平衡状态时,取vmL上层清液,用c1mol/LKSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1mL。
资料:Ag++SCN-
 AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012Fe3++SCN-
 FeSCN2++(红色) K2=102.3
FeSCN2++(红色) K2=102.3①滴定过程中Fe3+的作用是
②测得平衡常数K=
③取实验II的浊液测定c(Ag+),会使所测K值
您最近一年使用:0次
名校
解题方法
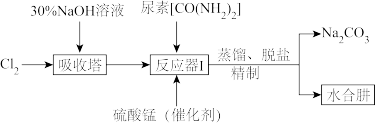
2 . 实验室模拟尿素法制备水合肼(N2H4·H2O)的流程如下:
已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(2)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。

①双极膜中产生的_______ (填“H+”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应: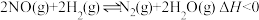 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
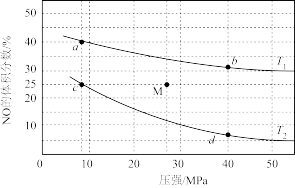
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点_______ 。

已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:
(2)反应器1要控制NaClO溶液的用量,其主要目的是
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成
 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应:
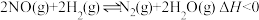 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点
您最近一年使用:0次
名校
解题方法
3 . 利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、 Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
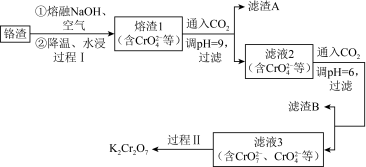
(1)铝热法冶炼金属铬,是利用了金属铝的_______ (填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有 、
、_______ 。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是_______ 。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______ 。
②滤渣B受热分解所得物质可以循环利用,B是_______ 。
③已知:2 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是_______ mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______ ,过滤得到K2Cr2O7粗品。

(1)铝热法冶炼金属铬,是利用了金属铝的
(2)溶液1中的阴离子有
 、
、(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol
 ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是
②滤渣B受热分解所得物质可以循环利用,B是
③已知:2
 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
您最近一年使用:0次
2022-05-25更新
|
132次组卷
|
5卷引用:北京市第二中学2022届高三下学期五月模拟考试化学试题
名校
解题方法
4 . 回答下列问题:
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g) CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
②该反应在200℃时的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如表:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)
(2)室温下,探究 NH4HCO3溶液的性质。
①室温时,NH4HCO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为_______ 。
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为_______ 。
(3)由重晶石矿 (主要成分是 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。

①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:_______ 。
②为提高产品产率, 结晶得到的氯化钡晶体常用_______ 进行洗涤。
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol•L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②该反应在200℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如表:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol•L-1) | 0.54 | 0.68 | 0.68 |
(2)室温下,探究 NH4HCO3溶液的性质。
| NH3•H2O | H2CO3 |
| Kb=1.8×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为
(3)由重晶石矿 (主要成分是
 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:
②为提高产品产率, 结晶得到的氯化钡晶体常用
您最近一年使用:0次
5 . 完成下列问题
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号) 和
和 从大到小排序:
从大到小排序:_________


_________ _________ _________ _________ _________
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号)
①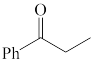

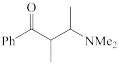
②


③

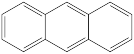
④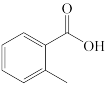


 和
和 从大到小排序:
从大到小排序:



(a)  (b)
(b) 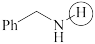 (c)
(c) 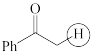 (d)
(d) 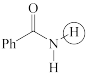 (e)
(e) 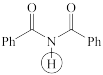
A. B.
B. C.
C.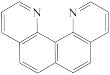 D.
D.
A.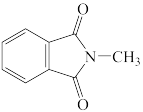 B.
B. C.
C. D.
D.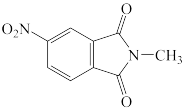
A. 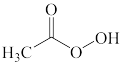 B.
B. 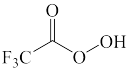 C.
C. 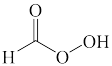 D.
D.  E.
E.  F.
F. 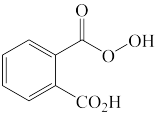
①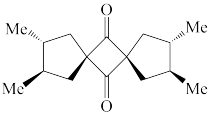 ②
② ③
③ ④
④ ⑤
⑤
⑥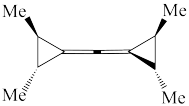 ⑦
⑦ ⑧
⑧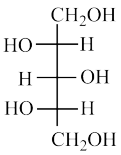 ⑨
⑨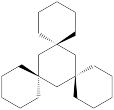 ⑩
⑩
您最近一年使用:0次
名校
解题方法
6 .  (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:

请回答下列问题:
(1)“浸渣”的主要成分是_______ (填化学式)。用硝酸替代“盐酸, ”也可以实现“酸浸”,从环保角度考虑,存在的缺点是
”也可以实现“酸浸”,从环保角度考虑,存在的缺点是_______ 。
(2)检验“酸浸”液中是否含 ,可选择的试剂是
,可选择的试剂是_______ (填标号)。
A.KSCN溶液 B. 溶液 C.KSCN溶液和双氧水
溶液 C.KSCN溶液和双氧水
(3)“除铁”的离子方程式为_______ 。
(4)已知 ,
,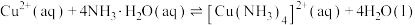 的平衡常数
的平衡常数 。
。 的平衡常数
的平衡常数
_______ 。
(5)探究 的性质:
的性质:
①实验Ⅱ中发生反应的离子方程式为_______ 。
②结合上述实验及所学知识,在酸性条件下, 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是_______ 。(填化学式)。
③结合上述流程中“氧化”步骤中发生的反应,说明 和
和 的氧化性相对强弱不一致的主要原因是
的氧化性相对强弱不一致的主要原因是_______ 。
 (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:
请回答下列问题:
(1)“浸渣”的主要成分是
 ”也可以实现“酸浸”,从环保角度考虑,存在的缺点是
”也可以实现“酸浸”,从环保角度考虑,存在的缺点是(2)检验“酸浸”液中是否含
 ,可选择的试剂是
,可选择的试剂是A.KSCN溶液 B.
 溶液 C.KSCN溶液和双氧水
溶液 C.KSCN溶液和双氧水(3)“除铁”的离子方程式为
(4)已知
 ,
,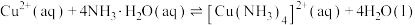 的平衡常数
的平衡常数 。
。 的平衡常数
的平衡常数
(5)探究
 的性质:
的性质:| 实验 | 操作 | 现象 |
| Ⅰ | 取少量 粉末于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 粉末于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝 |
| Ⅱ | 在稀硫酸酸化的 溶液中加入 溶液中加入 粉末,振荡 粉末,振荡 | 无色溶液变紫红色溶液 |
②结合上述实验及所学知识,在酸性条件下,
 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是③结合上述流程中“氧化”步骤中发生的反应,说明
 和
和 的氧化性相对强弱不一致的主要原因是
的氧化性相对强弱不一致的主要原因是
您最近一年使用:0次
2022-04-22更新
|
494次组卷
|
6卷引用:河北省部分学校2022届高三4月份联考化学试题
7 . 某小组为探究 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
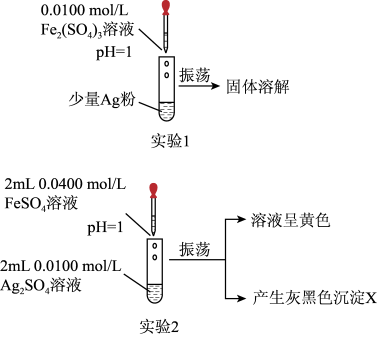
(1)实验1:如图所示,可得出的实验结论是___________ 。该实验不选用 的原因是
的原因是___________ 。
(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:___________ 。
②请用离子方程式解释产生红棕色气体的原因:___________ 。
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。
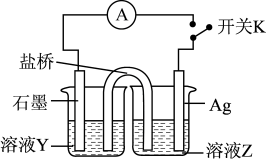
①溶液Y为___________ 。
②为实现该实验目的,接下来的操作及现象为___________ 。
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知, 下,
下,  (白色)
(白色) 
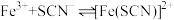 (红色)
(红色) 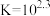
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液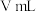 ,用
,用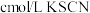 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗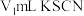 标准溶液。
标准溶液。
①判断滴定终点现象为___________ ;
②实验2试管中反应的平衡常数
___________ 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因:___________ 。
 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
(1)实验1:如图所示,可得出的实验结论是
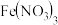 的原因是
的原因是(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:
②请用离子方程式解释产生红棕色气体的原因:
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。

①溶液Y为
②为实现该实验目的,接下来的操作及现象为
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知,
 下,
下,  (白色)
(白色) 
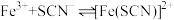 (红色)
(红色) 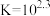
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液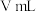 ,用
,用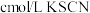 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗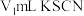 标准溶液。
标准溶液。①判断滴定终点现象为
②实验2试管中反应的平衡常数

③不取用实验1反应后所得清液测定反应的平衡常数的原因:
您最近一年使用:0次
名校
解题方法
8 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此碳的利用、捕集和减排成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。________ v逆(a)(填“>”“=”或“<”)。
②Ru/TiO2催化剂在较低温度主要选择_______ (填“反应I”或“反应II”)。
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是_______ 。
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=_______ L2•mol-2。
(2)合成碳酸二甲酯的工作原理如图所示。_______ ,离子交换膜a为_______ (填“阳膜”、“阴膜”)。
(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为_______ 。
②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。_______ 。两电极区间使用阳离子交换膜,不允许阴离子通过的原因是_______ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

②Ru/TiO2催化剂在较低温度主要选择
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=
(2)合成碳酸二甲酯的工作原理如图所示。

(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。

您最近一年使用:0次
名校
解题方法
9 . Ⅰ.工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O
(g) △H。回答下面问题:
(1)在某绝热容器中进行上述反应,下列能说明反应一定达到平衡状态的是_______ 。
A.当容器内温度不变时
B.当恒容混合气体密度不变时
C.当混合气体的颜色不变时
D.当恒压混合气体的总压强不变时
(2)在温度为T1和T2时,分别将0.40molCH4和1.0molNO2,充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。
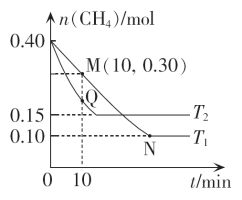
①温度为T1时,0~10min内NO2的平均反应速率v(NO2)=_______ 。
②温度为T2时,该反应的平衡常数K=_______ (保留两位有效数字)。
③下列措施中,能够使上述平衡正向移动,且提高NO2转化率的有_______ 。
A.使用高效催化剂
B.增加CH4的充入量
C.缩小容器体积,增大压强
D.恒容时,再次充入0.40molCH4和1.0molNO2
E.降低温度
Ⅱ.(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH 3-4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH3-4,使Fe3+转化为Fe(OH)3沉淀。
A.H2O2 B.CuO C.Cl2 D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据:常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,通过计算确定上述方案_______ (填“可行”或“不可行”)。
(g) △H。回答下面问题:
(1)在某绝热容器中进行上述反应,下列能说明反应一定达到平衡状态的是
A.当容器内温度不变时
B.当恒容混合气体密度不变时
C.当混合气体的颜色不变时
D.当恒压混合气体的总压强不变时
(2)在温度为T1和T2时,分别将0.40molCH4和1.0molNO2,充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。

①温度为T1时,0~10min内NO2的平均反应速率v(NO2)=
②温度为T2时,该反应的平衡常数K=
③下列措施中,能够使上述平衡正向移动,且提高NO2转化率的有
A.使用高效催化剂
B.增加CH4的充入量
C.缩小容器体积,增大压强
D.恒容时,再次充入0.40molCH4和1.0molNO2
E.降低温度
Ⅱ.(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH 3-4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:为除去溶液中的Fe2+,可先加入
A.H2O2 B.CuO C.Cl2 D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据:常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,通过计算确定上述方案
您最近一年使用:0次
2021-03-13更新
|
108次组卷
|
2卷引用:内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题
10 . I.研究氮和碳的化合物对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
合成氨反应 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+ H2(g)的活化能Ea2=
H2(g)的活化能Ea2=___________ kJ·mol-1。
(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
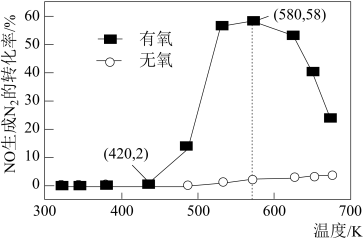
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=___________ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________ 。
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g) C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
(3)若要此反应自发进行___________ (填“高温”或“低温”)更有利。
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的Kp=___________ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:___________ 。(已知:NH3·H2O的K=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
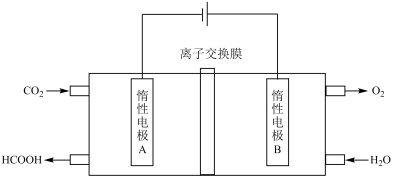
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为___________ 。
(1)化学键键能数据如下:
| 化学键 | H-H | N≡N | N-H |
| E/(kJ/mol) | 436 | 946 | 391 |
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+ H2(g)的活化能Ea2=
H2(g)的活化能Ea2=(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。(3)若要此反应自发进行
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P0 | 5.60 P0 | 5.30 P0 | 5.15 P0 | 5.06 P0 | 5.00 P0 | 5.00 P0 |
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为

您最近一年使用:0次



