名校
解题方法
1 . 甲烷是重要的资源,通过一系列过程可实现由甲烷到氢气的转化。
Ⅰ.500℃时,CH4与H2O重整主要发生下列反应:
反应1:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.1kJ/mol
CO(g)+3H2(g) ΔH=+206.1kJ/mol
反应2:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
(1)恒温恒容下,不能证明反应体系已达平衡的是_________
(2)已知:CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.8kJ/mol,向重整反应体系中加入适量多孔CaO,其优点是___________ 。
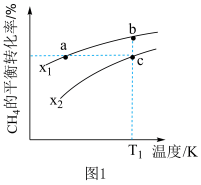
(3)向一恒容密闭容器中加入1molCH4和一定量的H2O,若只发生反应1,CH4的平衡转化率按不同投料x(x=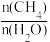 )随温度的变化曲线如图1所示。下列说法不正确的是
)随温度的变化曲线如图1所示。下列说法不正确的是
Ⅱ.CH4与CO2重整的主要反应的热化学方程式为
反应a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+246.5kJ/mol K1
反应b:H2(g)+CO2(g)=CO(g)+H2O(g) ΔH=+41.2kJ/mol K2
反应c:2CO(g)=CO2(g)+C(s) ΔH=-172.5kJ/mol K3
(4)在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g)=4CO(g)+8H2(g)的ΔH=___________ ,K=___________ (用K1、K2或K3表示)
(5)将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2时,若只发生反应a和反应b,CH4和CO2的平衡转化率随温度变化关系如图2所示。
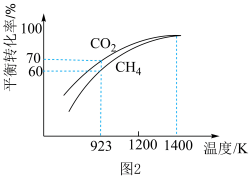
①请列出923K时反应a的化学平衡常数K的计算式(不用计算结果):K=___________ 。
②CH4还原能力R可衡量CO2转化效率,(R=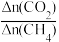 ),同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因是
),同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因是___________ 。
Ⅰ.500℃时,CH4与H2O重整主要发生下列反应:
反应1:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.1kJ/mol
CO(g)+3H2(g) ΔH=+206.1kJ/mol反应2:CO(g)+H2O(g)
 H2(g)+CO2(g)
H2(g)+CO2(g)(1)恒温恒容下,不能证明反应体系已达平衡的是_________
| A.体系的气体平均相对分子质量不变 |
| B.1molH2O消耗的同时有3molH2消耗 |
| C.体系的压强不再变化 |
| D.CO与H2的物质的量之比不再改变 |
(2)已知:CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.8kJ/mol,向重整反应体系中加入适量多孔CaO,其优点是
(3)向一恒容密闭容器中加入1molCH4和一定量的H2O,若只发生反应1,CH4的平衡转化率按不同投料x(x=
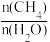 )随温度的变化曲线如图1所示。下列说法不正确的是
)随温度的变化曲线如图1所示。下列说法不正确的是
| A.x1>x2 |
| B.点a、b、c对应的平衡常数:Ka<Kb=Kc |
| C.反应速率:vb正<vc正 |
| D.反应温度为T1,当容器内压强不变时,反应达到平衡状态 |
Ⅱ.CH4与CO2重整的主要反应的热化学方程式为
反应a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+246.5kJ/mol K1
反应b:H2(g)+CO2(g)=CO(g)+H2O(g) ΔH=+41.2kJ/mol K2
反应c:2CO(g)=CO2(g)+C(s) ΔH=-172.5kJ/mol K3
(4)在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g)=4CO(g)+8H2(g)的ΔH=
(5)将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2时,若只发生反应a和反应b,CH4和CO2的平衡转化率随温度变化关系如图2所示。

①请列出923K时反应a的化学平衡常数K的计算式(不用计算结果):K=
②CH4还原能力R可衡量CO2转化效率,(R=
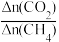 ),同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因是
),同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因是
您最近一年使用:0次
解题方法
2 .  加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。
加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。
(1)由 加氢生成
加氢生成 的反应为
的反应为
①若 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热
___________ 
②若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高 平衡转化率的措施有
平衡转化率的措施有___________ (写出两种)。
③下列说法可以证明该反应已达到平衡状态的是___________ (填字母)。
a.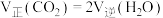 b.
b. 的物质的量分数不再改变
的物质的量分数不再改变
c.容器内气体密度不再改变 d. 和
和 的浓度之比为1:2
的浓度之比为1:2
e.混合气的平均摩尔质量不再变化 f.单位时间内生成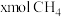 的同时又消耗
的同时又消耗
④ 催化加氢合成
催化加氢合成 过程中,
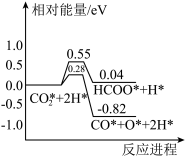
过程中, 活化的可能途径如有图所示,CO是
活化的可能途径如有图所示,CO是 活化的优势中间体,原因是
活化的优势中间体,原因是___________ 。
(2)一定条件下 与
与 也可以生成
也可以生成 ,某温度下在容积为2L的恒容密闭容器中充入
,某温度下在容积为2L的恒容密闭容器中充入 和一定量
和一定量 发生反应:
发生反应: 。
。 的平衡分压与起始投料比
的平衡分压与起始投料比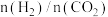 的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则
的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则
___________ 。b点时,再充入 和
和 ,使两者分压均增大0.2kPa,则此时平衡
,使两者分压均增大0.2kPa,则此时平衡___________ (填“正向”、“逆向”或“不”)移动。
(3)一定条件下 与
与 还可以生成甲酸,方程式为
还可以生成甲酸,方程式为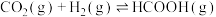
 。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 除了能分解成
除了能分解成 和
和 ,还能分解为CO和
,还能分解为CO和 ,反应为:
,反应为:
 ,则此平衡体系中CO或
,则此平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。

提示:CO(或氢气)的选择性
图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降可能的原因:___________ ;400°C时 的体积分数为
的体积分数为___________ 。
 加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。
加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。(1)由
 加氢生成
加氢生成 的反应为
的反应为
①若
 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热

| 物质 |  |  |  |  |
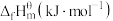 |  | 0 | 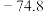 | 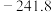 |
 平衡转化率的措施有
平衡转化率的措施有③下列说法可以证明该反应已达到平衡状态的是
a.
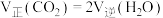 b.
b. 的物质的量分数不再改变
的物质的量分数不再改变c.容器内气体密度不再改变 d.
 和
和 的浓度之比为1:2
的浓度之比为1:2e.混合气的平均摩尔质量不再变化 f.单位时间内生成
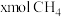 的同时又消耗
的同时又消耗
④
 催化加氢合成
催化加氢合成 过程中,
过程中, 活化的可能途径如有图所示,CO是
活化的可能途径如有图所示,CO是 活化的优势中间体,原因是
活化的优势中间体,原因是
(2)一定条件下
 与
与 也可以生成
也可以生成 ,某温度下在容积为2L的恒容密闭容器中充入
,某温度下在容积为2L的恒容密闭容器中充入 和一定量
和一定量 发生反应:
发生反应: 。
。 的平衡分压与起始投料比
的平衡分压与起始投料比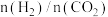 的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则
的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则
 和
和 ,使两者分压均增大0.2kPa,则此时平衡
,使两者分压均增大0.2kPa,则此时平衡
(3)一定条件下
 与
与 还可以生成甲酸,方程式为
还可以生成甲酸,方程式为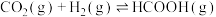
 。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 除了能分解成
除了能分解成 和
和 ,还能分解为CO和
,还能分解为CO和 ,反应为:
,反应为:
 ,则此平衡体系中CO或
,则此平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
提示:CO(或氢气)的选择性

图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降可能的原因:
 的体积分数为
的体积分数为
您最近一年使用:0次
3 . 氨是一种重要的化工原料和储氢材料。回答下列问题:
(1)已知反应:
① □
□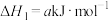
② □
□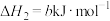
③ □
□
则反应 的
的
_______  。
。
(2)在恒容密闭容器中,发生反应 ,下列说法可以证明反应已达到平衡状态的是
,下列说法可以证明反应已达到平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时生成
的同时生成
B.1个 键断裂的同时,有6个
键断裂的同时,有6个 键形成
键形成
C.1个 键断裂的同时,有3个
键断裂的同时,有3个 键形成
键形成
D.混合气体的密度不再改变的状态
E.混合气体的压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(3)已知 和
和 以物质的量之比为
以物质的量之比为 在不同温度和压强下发生反应:
在不同温度和压强下发生反应: ,测得平衡体系中
,测得平衡体系中 的物质的量分数如图所示。
的物质的量分数如图所示。
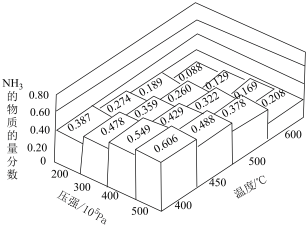
图中所示的平衡体系中 的物质的量分数为0.488和0.429时,该反应的平衡常数分别为
的物质的量分数为0.488和0.429时,该反应的平衡常数分别为 、
、 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)在一定条件下,向某反应容器中投入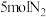 和
和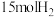 ,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
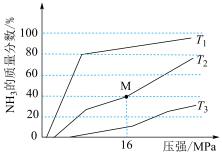
①温度 、
、 、
、 中,最大的是
中,最大的是_______ 。
② 点
点 的转化率为
的转化率为_______ 。
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入 和
和 (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
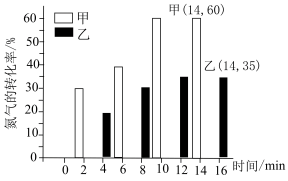
①相对于乙,甲改变的条件是_______ (填字母)。
A.增大压强 B.升高温度 C.加入催化剂 D.分离氨
②在甲条件下,平衡时体积为 ,则该反应的平衡常数
,则该反应的平衡常数 为
为_______ (结果保留三位有效数字)。
(1)已知反应:
①
 □
□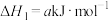
②
 □
□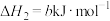
③
 □
□
则反应
 的
的
 。
。(2)在恒容密闭容器中,发生反应
 ,下列说法可以证明反应已达到平衡状态的是
,下列说法可以证明反应已达到平衡状态的是A.单位时间内生成
 的同时生成
的同时生成
B.1个
 键断裂的同时,有6个
键断裂的同时,有6个 键形成
键形成C.1个
 键断裂的同时,有3个
键断裂的同时,有3个 键形成
键形成D.混合气体的密度不再改变的状态
E.混合气体的压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(3)已知
 和
和 以物质的量之比为
以物质的量之比为 在不同温度和压强下发生反应:
在不同温度和压强下发生反应: ,测得平衡体系中
,测得平衡体系中 的物质的量分数如图所示。
的物质的量分数如图所示。
图中所示的平衡体系中
 的物质的量分数为0.488和0.429时,该反应的平衡常数分别为
的物质的量分数为0.488和0.429时,该反应的平衡常数分别为 、
、 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)在一定条件下,向某反应容器中投入
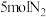 和
和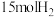 ,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
①温度
 、
、 、
、 中,最大的是
中,最大的是②
 点
点 的转化率为
的转化率为(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入
 和
和 (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
①相对于乙,甲改变的条件是
A.增大压强 B.升高温度 C.加入催化剂 D.分离氨
②在甲条件下,平衡时体积为
 ,则该反应的平衡常数
,则该反应的平衡常数 为
为
您最近一年使用:0次
名校
解题方法
4 . 25℃时,向40 mL 0.05 mol/L的 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应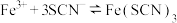 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是
 溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应
溶液中一次性加入10 mL 0.15 mol/L的KSCN溶液(体积变化忽略不计),发生反应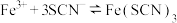 ,混合溶液中
,混合溶液中 与反应时间(t)的变化如图所示。下列说法不正确的是
与反应时间(t)的变化如图所示。下列说法不正确的是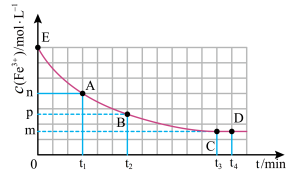
A. 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动。 |
| B.E点对应的坐标为(0,0.04) |
C.在25℃时该反应的平衡常数为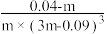 |
D. 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 分钟后加入少量KSCN固体,溶液红色加深,该现象可以证明 与SCN-的反应是可逆反应 与SCN-的反应是可逆反应 |
您最近一年使用:0次
2023-12-12更新
|
233次组卷
|
3卷引用:北京市第十二中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 以 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用 合成
合成 ,方程式为:
,方程式为: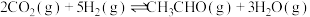
已知生成乙醛的净反应速率为 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下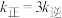 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
__________ 。
二、电化学技术
(2)研究证明 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是____________________ 。
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。
反应Ⅰ
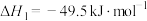
反应Ⅱ
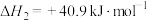
回答下列问题:
(3)下列说法不正确 的是__________。
(4)其他条件相同,仅改变容器体积,实验测得 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是________________ 。
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①C、D二点对应的反应温度 、
、 的关系是
的关系是__________ 。
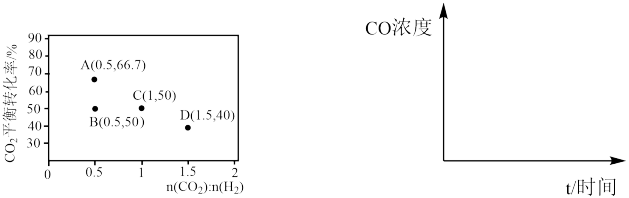
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明 和
和
_______ 。
 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用
 合成
合成 ,方程式为:
,方程式为: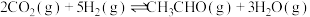
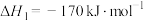
已知生成乙醛的净反应速率为
 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下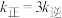 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
二、电化学技术
(2)研究证明
 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的
 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。反应Ⅰ

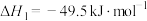
反应Ⅱ

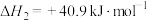
回答下列问题:
(3)下列说法
A.反应Ⅰ的活化能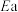 大于反应Ⅱ 大于反应Ⅱ | B.容器内压强不变时可以判断反应达到平衡 |
C.该温度下,反应Ⅱ的 大于零 大于零 | D.使用性能更佳的催化剂可以提高 平衡转化率 平衡转化率 |
 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整
 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。①C、D二点对应的反应温度
 、
、 的关系是
的关系是②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明
 和
和

您最近一年使用:0次
6 . 臭氧也是理想的烟气脱硝剂,其脱硝反应之一为: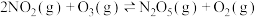
 。
。
(1)某温度时,在体积为1L的刚性密闭容器中充入 和
和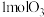 发生反应。
发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是_______ (填标号)。
A. 的消耗速率与
的消耗速率与 的消耗速率相等 B.混合气体压强不再改变
的消耗速率相等 B.混合气体压强不再改变
C.混合气体的平均相对分子质量保持不变 D. 与
与 的物质的量浓度相等
的物质的量浓度相等
②欲增加 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有_______ (填标号)。
A.充入氦气 B.升高温度 C.充入 D.充入
D.充入 和
和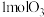
(2)若 时将
时将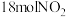 和
和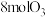 充入容积为2L的密闭容器中发生反应:
充入容积为2L的密闭容器中发生反应: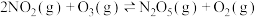 ,
, 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①在 条件下0-5min内,以
条件下0-5min内,以 表示的该反应速率
表示的该反应速率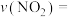
_______ ,该条件下的平衡常数
___________ 。
②若15min时,保持 不变,向该容器中再加入该四种反应混合物各1mol,则此时反应
不变,向该容器中再加入该四种反应混合物各1mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”);
③ 达到平衡后,保持其他条件不变,在
达到平衡后,保持其他条件不变,在 时刻迅速将容器体积压缩至1L,
时刻迅速将容器体积压缩至1L, 时重新达到平衡,请在图中画出
时重新达到平衡,请在图中画出 时刻后
时刻后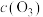 的变化趋势
的变化趋势___________ 。

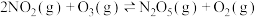
 。
。(1)某温度时,在体积为1L的刚性密闭容器中充入
 和
和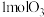 发生反应。
发生反应。①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是
A.
 的消耗速率与
的消耗速率与 的消耗速率相等 B.混合气体压强不再改变
的消耗速率相等 B.混合气体压强不再改变C.混合气体的平均相对分子质量保持不变 D.
 与
与 的物质的量浓度相等
的物质的量浓度相等②欲增加
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.充入氦气 B.升高温度 C.充入
 D.充入
D.充入 和
和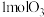
(2)若
 时将
时将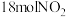 和
和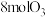 充入容积为2L的密闭容器中发生反应:
充入容积为2L的密闭容器中发生反应: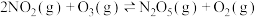 ,
, 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 物质的量/mol | 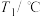 | |||
| 0 | 5min | 10min | 15min | |
 | 8.0 | 3.5 | 2.0 | 2.0 |
 条件下0-5min内,以
条件下0-5min内,以 表示的该反应速率
表示的该反应速率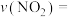

②若15min时,保持
 不变,向该容器中再加入该四种反应混合物各1mol,则此时反应
不变,向该容器中再加入该四种反应混合物各1mol,则此时反应③
 达到平衡后,保持其他条件不变,在
达到平衡后,保持其他条件不变,在 时刻迅速将容器体积压缩至1L,
时刻迅速将容器体积压缩至1L, 时重新达到平衡,请在图中画出
时重新达到平衡,请在图中画出 时刻后
时刻后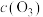 的变化趋势
的变化趋势
您最近一年使用:0次
解题方法
7 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,能证明氢硫酸的酸性比亚硫酸的酸性弱的是___________(填标号)。
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为___________ 、___________ ,
制得等量H2所需能量较少的是___________ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①向反应器中再分别充入下列气体,能使H2S转化率增大的是___________ (填标号)。
A.H2S B.CO2 C.COS D.N2
②求610 K时,该反应的平衡常数K=___________ (写出详细的解答过程)。
(1)下列事实中,能证明氢硫酸的酸性比亚硫酸的酸性弱的是___________(填标号)。
| A.氢硫酸能还原亚硫酸生成硫单质和水 |
| B.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| C.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| D.氢硫酸的导电能力低于亚硫酸 |

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
制得等量H2所需能量较少的是
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
②求610 K时,该反应的平衡常数K=
您最近一年使用:0次
8 . 回答下列问题。
(1)向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入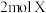 气体和
气体和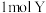 固体,在一定温度下发生反应:
固体,在一定温度下发生反应: 。已知该反应在不同温度下的平衡常数如下:
。已知该反应在不同温度下的平衡常数如下:
该反应的平衡常数的表达式
___________ ,
___________ 0(填“>”“<”“=”)。
(2)在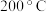 时,上述容器充入
时,上述容器充入 、
、 和
和 气体,则平衡向
气体,则平衡向___________ (填“左”或“右”或“不移动”)。
(3)臭氧是理想的烟气脱硝剂,其脱硝反应之一为: 某温度时,在体积为
某温度时,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入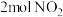 和
和 发生反应。
发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是___________ (填标号)。
A. B.混合气体密度不再改变
B.混合气体密度不再改变
C. 的体积分数不再改变 D.
的体积分数不再改变 D. 与
与 的体积比不再改变
的体积比不再改变
②欲增加 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有___________ (填标号)。
A.充入氦气 B.升高温度 C.充入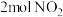 D.充入
D.充入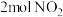 和
和
③达到平衡时,混合气体总压为p, 的浓度为
的浓度为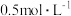 ,则
,则 的转化率为
的转化率为___________ ,平衡常数
___________ (以分压表示,分压=总压×物质的量分数)。
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________ 。
a.及时分离出 气体 b.适当升高温度 c.增大
气体 b.适当升高温度 c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂
(1)向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入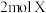 气体和
气体和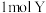 固体,在一定温度下发生反应:
固体,在一定温度下发生反应: 。已知该反应在不同温度下的平衡常数如下:
。已知该反应在不同温度下的平衡常数如下:温度/ | 100 | 150 | 200 |
| 平衡常数 | 1 | 1.2 | 1.4 |


(2)在
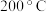 时,上述容器充入
时,上述容器充入 、
、 和
和 气体,则平衡向
气体,则平衡向(3)臭氧是理想的烟气脱硝剂,其脱硝反应之一为:
 某温度时,在体积为
某温度时,在体积为 的刚性密闭容器中充入
的刚性密闭容器中充入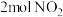 和
和 发生反应。
发生反应。①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是
A.
 B.混合气体密度不再改变
B.混合气体密度不再改变C.
 的体积分数不再改变 D.
的体积分数不再改变 D. 与
与 的体积比不再改变
的体积比不再改变②欲增加
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.充入氦气 B.升高温度 C.充入
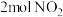 D.充入
D.充入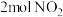 和
和
③达到平衡时,混合气体总压为p,
 的浓度为
的浓度为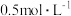 ,则
,则 的转化率为
的转化率为
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出
 气体 b.适当升高温度 c.增大
气体 b.适当升高温度 c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组通过以下实验探究,加深对化学反应速率和化学反应限度的认识,并测定化学反应的平衡常数。
实验一:探究温度和浓度对反应速率的影响
【实验原理及方案】在酸性溶液中,碘酸钾 和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
(1)上述表格中: =
=___________ mL, =
=___________ 。
(2)酸性溶液中,碘酸钾和亚硫酸钠反应的离子方程式为___________ 。
实验二:探究KI和 的反应存在一定的限度
的反应存在一定的限度
【实验步骤】ⅰ.向 溶液中滴加5~6滴
溶液中滴加5~6滴 溶液,充分反应后,将所得溶液分成甲、乙两等份;
溶液,充分反应后,将所得溶液分成甲、乙两等份;
ⅱ.向甲中滴加 ,充分振荡;
,充分振荡;
ⅲ.向乙中滴加 溶液。
溶液。
(3)证明反应存在一定限度的实验现象是:步骤ⅱ中___________ ;步骤ⅲ中___________ 。
实验三:测定反应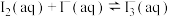 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的试剂,振荡半小时。取一定体积的上层清液用标准 溶液进行滴定,测定
溶液进行滴定,测定 和
和 的总浓度。
的总浓度。

(4)不能用普通锥形瓶代替碘量瓶的原因___________ 。
(5)为了判断用 溶液滴定上层清液时的滴定终点,需要选择的指示剂为
溶液滴定上层清液时的滴定终点,需要选择的指示剂为___________ 。
(6)0.5g的碘不需要精确称量的理由是:在水中或KI溶液中,___________ ,故I2(aq)浓度不随碘固体的质量增大而增大。
(7)碘量瓶①平衡体系中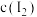 与②中
与②中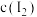 接近,列出平衡常数K的计算式
接近,列出平衡常数K的计算式___________ (只列出计算式即可,不要求计算)。
实验一:探究温度和浓度对反应速率的影响
【实验原理及方案】在酸性溶液中,碘酸钾
 和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。| 实验序号 |  酸性溶液(含淀粉)的体积/mL 酸性溶液(含淀粉)的体积/mL |  溶液的体积/mL 溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 记录出现蓝色的时间/s |
| ① | 5 | 5 |  | 0 |  |
| ② | 5 | 5 | 40 | 25 |  |
| ③ | 5 |  | 35 | 25 |  |
 =
= =
=(2)酸性溶液中,碘酸钾和亚硫酸钠反应的离子方程式为
实验二:探究KI和
 的反应存在一定的限度
的反应存在一定的限度【实验步骤】ⅰ.向
 溶液中滴加5~6滴
溶液中滴加5~6滴 溶液,充分反应后,将所得溶液分成甲、乙两等份;
溶液,充分反应后,将所得溶液分成甲、乙两等份;ⅱ.向甲中滴加
 ,充分振荡;
,充分振荡;ⅲ.向乙中滴加
 溶液。
溶液。(3)证明反应存在一定限度的实验现象是:步骤ⅱ中
实验三:测定反应
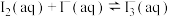 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的试剂,振荡半小时。取一定体积的上层清液用标准
 溶液进行滴定,测定
溶液进行滴定,测定 和
和 的总浓度。
的总浓度。| 编号 |  碘量瓶① 碘量瓶① |  碘量瓶② 碘量瓶② |
| 试剂 | 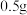 研细的碘 研细的碘 溶液 溶液 | 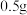 研细的碘 研细的碘 |
 和 和 的总浓度 的总浓度 |  |  |

(4)不能用普通锥形瓶代替碘量瓶的原因
(5)为了判断用
 溶液滴定上层清液时的滴定终点,需要选择的指示剂为
溶液滴定上层清液时的滴定终点,需要选择的指示剂为(6)0.5g的碘不需要精确称量的理由是:在水中或KI溶液中,
(7)碘量瓶①平衡体系中
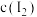 与②中
与②中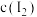 接近,列出平衡常数K的计算式
接近,列出平衡常数K的计算式
您最近一年使用:0次
名校
解题方法
10 . 化学平衡是中学化学的重点研究对象
I.氮及其化合物是重要的化工原料。回答下列问题:
(1)汽车尾气的储存还原技术法(NSR)可有效消除机动车尾气中NOx和CO的排放。
已知:

则2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H3=___________ kJ∙mol-1。
(2)在不同压强下,向恒容密闭容器中通入初始浓度为3.0molmol∙L-1NO、1.0mol∙L-1 ,使其发生反应:
,使其发生反应: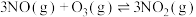
 kJ•mol-1。测得平衡时
kJ•mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:

① 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②下列数据能表明反应处于平衡状态的是___________ (填字母)。
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C. D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变
③温度为 时,反应的平衡常数
时,反应的平衡常数
___________ (填具体数字)。
(3)对于可逆反应 ,若起始投料
,若起始投料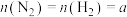 mol,达到平衡后,增大压强,
mol,达到平衡后,增大压强, 的体积分数
的体积分数___________ (填“增大”“减小”或“不变”)。
Ⅱ.
(4)水是极弱的电解质,常温下某电解质溶解在水中后,溶液中的 mol∙L-1,则该电解质可能是___________(填字母)。
mol∙L-1,则该电解质可能是___________(填字母)。
(5)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的 增大,可以采取的措施为___________(填字母)。
增大,可以采取的措施为___________(填字母)。
(6)常温下,为证明 是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系
是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系___________ (用等式或不等式表示),就可确认 是弱电解质。
是弱电解质。
(7)已知:25℃时,两种常见弱酸的电离平衡常数:
①25℃时,10mL0.10mol⋅L
 溶液与10mL0.10mol•L-1
溶液与10mL0.10mol•L-1 溶液中,离子总数大小关系:
溶液中,离子总数大小关系: 溶液
溶液___________  溶液(填“>”、“<”或“=”)。
溶液(填“>”、“<”或“=”)。
②向 溶液中通入过量
溶液中通入过量 反应的离子方程式为
反应的离子方程式为___________ 。
(8)已知:常温下, ,(在溶液中某离子完全沉淀时,认为该离子浓度小于
,(在溶液中某离子完全沉淀时,认为该离子浓度小于 )
)
① 的溶度积常数表达式
的溶度积常数表达式
___________ 。
② 完全沉淀的
完全沉淀的 为
为___________ 。
I.氮及其化合物是重要的化工原料。回答下列问题:
(1)汽车尾气的储存还原技术法(NSR)可有效消除机动车尾气中NOx和CO的排放。
已知:


则2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H3=
(2)在不同压强下,向恒容密闭容器中通入初始浓度为3.0molmol∙L-1NO、1.0mol∙L-1
 ,使其发生反应:
,使其发生反应: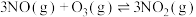
 kJ•mol-1。测得平衡时
kJ•mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
①
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②下列数据能表明反应处于平衡状态的是
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.
 D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变③温度为
 时,反应的平衡常数
时,反应的平衡常数
(3)对于可逆反应
 ,若起始投料
,若起始投料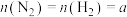 mol,达到平衡后,增大压强,
mol,达到平衡后,增大压强, 的体积分数
的体积分数Ⅱ.
(4)水是极弱的电解质,常温下某电解质溶解在水中后,溶液中的
 mol∙L-1,则该电解质可能是___________(填字母)。
mol∙L-1,则该电解质可能是___________(填字母)。A. | B.HCl | C. | D.NaOH |
(5)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的
 增大,可以采取的措施为___________(填字母)。
增大,可以采取的措施为___________(填字母)。A.再通入 | B.加碳酸钙粉末 | C.加氯化钠溶液 | D.加足量NaOH |
(6)常温下,为证明
 是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系
是弱电解质,某同学取出10mL0·10mol•L-1氨水,用pH试纸测其pH为a;用蒸馏水稀释至1000mL,再用pH试纸测其pH为b;只要a、b满足关系 是弱电解质。
是弱电解质。(7)已知:25℃时,两种常见弱酸的电离平衡常数:
| 酸 | 电离平衡常数 |
 |  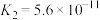 |
 | 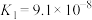 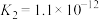 |

 溶液与10mL0.10mol•L-1
溶液与10mL0.10mol•L-1 溶液中,离子总数大小关系:
溶液中,离子总数大小关系: 溶液
溶液 溶液(填“>”、“<”或“=”)。
溶液(填“>”、“<”或“=”)。②向
 溶液中通入过量
溶液中通入过量 反应的离子方程式为
反应的离子方程式为(8)已知:常温下,
 ,(在溶液中某离子完全沉淀时,认为该离子浓度小于
,(在溶液中某离子完全沉淀时,认为该离子浓度小于 )
)①
 的溶度积常数表达式
的溶度积常数表达式
②
 完全沉淀的
完全沉淀的 为
为
您最近一年使用:0次



