名校
解题方法
1 . 当前,我国公布了实现“碳达峰、碳中和”目标的具体时间。因此,含碳化合物的综合利用,有效缓解温室效应成为研究热点。回答下列问题:
(1)CO2可与 H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1=-49 kJ·mol-1
H1=-49 kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2=+41 kJ·mol-1
H2=+41 kJ·mol-1
则:Ⅲ.CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)  H=
H=___________ 。
若将物质的量之比为1:2的 CO 和 H2 充入恒温恒容密闭容器中进行反应Ⅲ,下列事实能说明此反应已达到平衡状态的是___________ 。
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.V(CO)和 v(H2) 的速率之比为 1:2
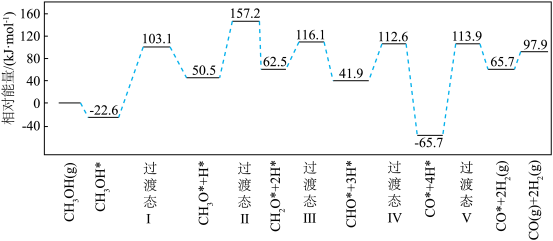
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea=___________ kJ·mol-1,写出该步骤的化学方程式:___________ 。 和
和 充入
充入 恒容密闭容器中进行反应Ⅲ,反应相同时间
恒容密闭容器中进行反应Ⅲ,反应相同时间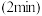 时测得不同温度下
时测得不同温度下 的转化率如图所示:
的转化率如图所示:___________ 。
A.升高温度 B.充入Ar使压强增大 C.充入CO使压强增大 D.选择高效催化剂
②温度在 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率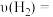
___________ 。
③由图可知,在温度低于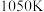 时,CO的转化率随温度的升高而增大,原因是
时,CO的转化率随温度的升高而增大,原因是___________ 。
④已知c点时容器内气体的压强为p,则在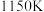 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为___________ 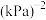 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(1)CO2可与 H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1=-49 kJ·mol-1
H1=-49 kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2=+41 kJ·mol-1
H2=+41 kJ·mol-1则:Ⅲ.CO(g) + 2H2(g)
 CH3OH(g)
CH3OH(g)  H=
H=若将物质的量之比为1:2的 CO 和 H2 充入恒温恒容密闭容器中进行反应Ⅲ,下列事实能说明此反应已达到平衡状态的是
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.V(CO)和 v(H2) 的速率之比为 1:2
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea=
 和
和 充入
充入 恒容密闭容器中进行反应Ⅲ,反应相同时间
恒容密闭容器中进行反应Ⅲ,反应相同时间 时测得不同温度下
时测得不同温度下 的转化率如图所示:
的转化率如图所示: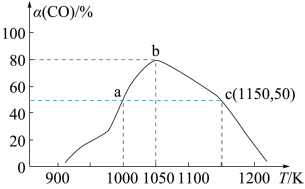
A.升高温度 B.充入Ar使压强增大 C.充入CO使压强增大 D.选择高效催化剂
②温度在
 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率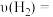
③由图可知,在温度低于
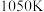 时,CO的转化率随温度的升高而增大,原因是
时,CO的转化率随温度的升高而增大,原因是④已知c点时容器内气体的压强为p,则在
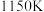 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为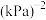 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
2 . 丙烯腈(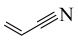 )是一种重要的化工原料,以
)是一种重要的化工原料,以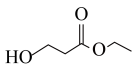 为原料合成丙烯腈的过程如下:
为原料合成丙烯腈的过程如下:

向密闭容器中通入一定量的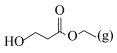 和
和 ,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数
,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数 ]随温度的变化如图。下列说法错误的是
]随温度的变化如图。下列说法错误的是
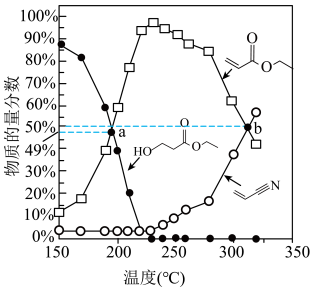
| A.“脱水”反应为吸热反应 |
| B.低于225℃时,“腈化”过程转化率低 |
C.a点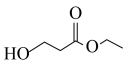 的转化率为51% 的转化率为51% |
D.b点 和 和 的物质的量之比为3:1 的物质的量之比为3:1 |
您最近一年使用:0次
2024-05-24更新
|
195次组卷
|
3卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
解题方法
3 . 实现碳的氧化物循环利用在工业上占有重要的地位。一氧化碳加氢制甲醇的原理为 。回答下列问题;
。回答下列问题;
(1)用甲醇燃料电池作为外接电源按图1所示电解硫酸铜溶液,起始时盛有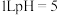 的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量)。
足量)。
①电解的总反应方程式为______ ,此时可观察到的现象是______ 。
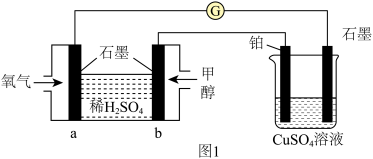
②一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______ (填物质名称),其质量约为______ g。
(2)在不同条件下,向体积可变的密闭容器中充入0.50molCO(g)和1.00molH2(g)的混合气体,实验测得平衡时CH3OH的物质的量随温度、压强的变化如图2所示。
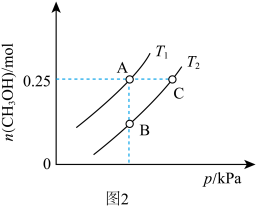
则温度:
______ (填“>”“<”或“=”) 三点对应的平衡常数由大到小关系为
三点对应的平衡常数由大到小关系为______ 。
(3)一定温度下,向恒容密闭容器中充入 和
和 混合气体,测得初始压强为
混合气体,测得初始压强为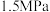 。反应至
。反应至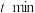 时,恢复到原来温度,测得
时,恢复到原来温度,测得 的转化率为
的转化率为 。已知正反应速率
。已知正反应速率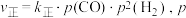 为分压(分压=总压
为分压(分压=总压 物质的量分数)。若该条件下
物质的量分数)。若该条件下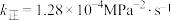 ,则
,则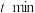 时,
时,
______ 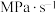 。若升高温,k正
。若升高温,k正______ (填“增大”“减小”或“不变”)。
 。回答下列问题;
。回答下列问题;(1)用甲醇燃料电池作为外接电源按图1所示电解硫酸铜溶液,起始时盛有
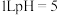 的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量)。
足量)。①电解的总反应方程式为

②一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入
(2)在不同条件下,向体积可变的密闭容器中充入0.50molCO(g)和1.00molH2(g)的混合气体,实验测得平衡时CH3OH的物质的量随温度、压强的变化如图2所示。

则温度:

 三点对应的平衡常数由大到小关系为
三点对应的平衡常数由大到小关系为(3)一定温度下,向恒容密闭容器中充入
 和
和 混合气体,测得初始压强为
混合气体,测得初始压强为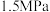 。反应至
。反应至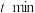 时,恢复到原来温度,测得
时,恢复到原来温度,测得 的转化率为
的转化率为 。已知正反应速率
。已知正反应速率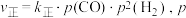 为分压(分压=总压
为分压(分压=总压 物质的量分数)。若该条件下
物质的量分数)。若该条件下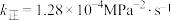 ,则
,则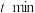 时,
时,
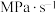 。若升高温,k正
。若升高温,k正
您最近一年使用:0次
名校
解题方法
4 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为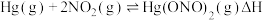
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

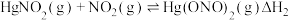

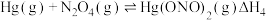
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为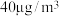 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中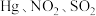 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于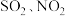 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

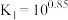
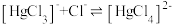
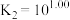
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随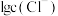 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为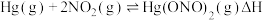
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
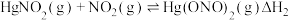

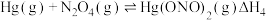
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
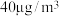 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于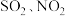 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是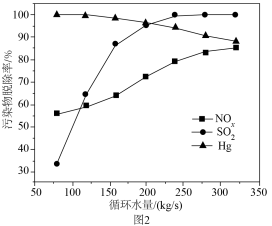
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
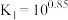
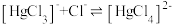
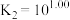
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随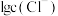 的变化如图所示
的变化如图所示
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
2024-03-01更新
|
522次组卷
|
3卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
2024高三下·全国·专题练习
5 . 空气中CO2含量的控制和CO2资源利用具有重要意义。
已知25℃、101 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
I.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2kJ·mol-1
II.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1
III.CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH3=-165kJ·mol-1
向刚性密闭容器中通入一定量CO2和H2,发生反应I和反应II,温度对 和CH3OH的物质的量分数影响如图所示。
和CH3OH的物质的量分数影响如图所示。
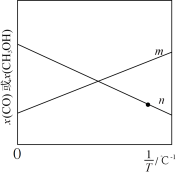
图中表示 物质的量分数的为
物质的量分数的为_______ (填“m”或“n”);为提高CH3OH的选择性,可采取的措施有_______ (写出1条即可)。
已知25℃、101
 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:I.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2kJ·mol-1
II.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1
III.CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH3=-165kJ·mol-1
向刚性密闭容器中通入一定量CO2和H2,发生反应I和反应II,温度对
 和CH3OH的物质的量分数影响如图所示。
和CH3OH的物质的量分数影响如图所示。
图中表示
 物质的量分数的为
物质的量分数的为
您最近一年使用:0次
名校
解题方法
6 . 向 溶液中滴加
溶液中滴加 溶液,发生反应
溶液,发生反应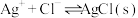 和
和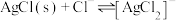 。
。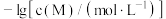 与
与 的关系如下图所示(其中
的关系如下图所示(其中 代表
代表 或
或 )。下列说法错误的是
)。下列说法错误的是
 溶液中滴加
溶液中滴加 溶液,发生反应
溶液,发生反应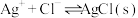 和
和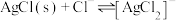 。
。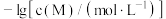 与
与 的关系如下图所示(其中
的关系如下图所示(其中 代表
代表 或
或 )。下列说法错误的是
)。下列说法错误的是
A.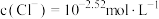 时,溶液中 时,溶液中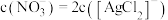 |
B.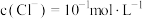 时,溶液中 时,溶液中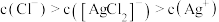 |
C. 的平衡常数 的平衡常数 的值为 的值为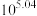 |
D.用 沉淀 沉淀 ,溶液中 ,溶液中 浓度过大时,沉淀效果不好 浓度过大时,沉淀效果不好 |
您最近一年使用:0次
2024-01-22更新
|
1198次组卷
|
6卷引用:2024年1月安徽普通高等学校招生考试适应性测试化学试题
2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)选择题11-14(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析重庆市第八中学2023-2024学年高二下学期第一次月考化学试卷安徽省合肥市第一中学2023-2024学年高二下学期素质拓展(2)化学试题
名校
解题方法
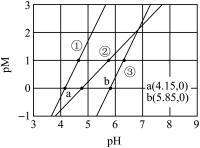
7 . 常温下,向含有CH3COOH、CuSO4、FeSO4的工业废水中逐滴加入NaOH溶液,pM随pH变化关系如图所示[pM表示 或
或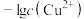 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: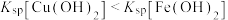 ;当离子浓度
;当离子浓度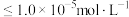 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
 或
或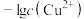 或
或 ],曲线①③斜率相同。已知:
],曲线①③斜率相同。已知: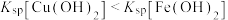 ;当离子浓度
;当离子浓度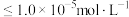 时,可认为该离子沉淀完全。下列说法不正确的是
时,可认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示 与pH的关系 与pH的关系 |
B.pH=6时,溶液中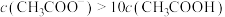 |
C.pH=7时,可认为 沉淀完全 沉淀完全 |
D.pH=8时 |
您最近一年使用:0次
2023-12-01更新
|
422次组卷
|
5卷引用:河北省沧州市部分高中2023-2024学年高三上学期11月期中考试化学试题
河北省沧州市部分高中2023-2024学年高三上学期11月期中考试化学试题(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)(已下线)选择题11-15安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
解题方法
8 . 一碘甲烷 热裂解可制取乙烯等低碳渊烃,主要反应有;
热裂解可制取乙烯等低碳渊烃,主要反应有;
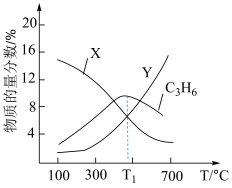
反应Ⅰ:
反应Ⅱ:3C2H4(g) 2C3H6(g)
2C3H6(g) 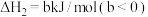
反应Ⅲ:2C2H4(g) C4H8(g)
C4H8(g) 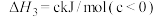
在体积为 的密闭容器中,起始投料
的密闭容器中,起始投料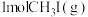 ,平衡体系中各烯烃的物质的量分数随温度的变化如图所示,下列说法正确的是
,平衡体系中各烯烃的物质的量分数随温度的变化如图所示,下列说法正确的是
 热裂解可制取乙烯等低碳渊烃,主要反应有;
热裂解可制取乙烯等低碳渊烃,主要反应有;
反应Ⅰ:

反应Ⅱ:3C2H4(g)
 2C3H6(g)
2C3H6(g) 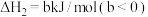
反应Ⅲ:2C2H4(g)
 C4H8(g)
C4H8(g) 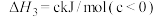
在体积为
 的密闭容器中,起始投料
的密闭容器中,起始投料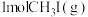 ,平衡体系中各烯烃的物质的量分数随温度的变化如图所示,下列说法正确的是
,平衡体系中各烯烃的物质的量分数随温度的变化如图所示,下列说法正确的是A.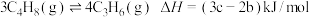 |
B.曲线 表示 表示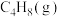 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
C. ℃平衡体系中, ℃平衡体系中,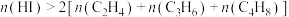 |
D.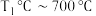 之间,温度对反应Ⅱ的影响小于 之间,温度对反应Ⅱ的影响小于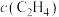 对反应Ⅱ的影响 对反应Ⅱ的影响 |
您最近一年使用:0次
2023-07-05更新
|
468次组卷
|
2卷引用:四川省德阳市2022-2023学年高二下学期期末考试化学试题
解题方法
9 . 丙烯是重要的化工原料,丙烷直接脱氢制丙烯的相关反应及能量变化如图。
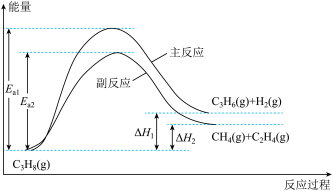
回答下列问题:
(1)主反应的焓变
______ 0(填“>”或“<”);在600℃、1MPa条件下,丙烷脱氢制丙烯反应到达平衡,测得 、
、 的体积分数均为30%,则此时
的体积分数均为30%,则此时 的体积分数为
的体积分数为____________ 。
(2)向密闭容器中充入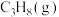 ,发生主反应:
,发生主反应: (忽略副反应的发生)。
(忽略副反应的发生)。
①测得反应速率方程为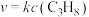 ,k为反应速率常数。已知:
,k为反应速率常数。已知: (R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是______ (填“Catl”或“Cat2”)。
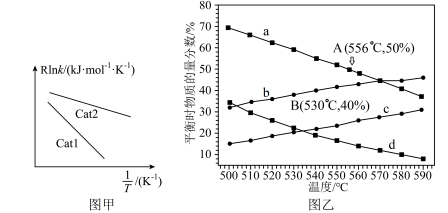
②在100 kPa、10 kPa不同起始压强下达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图乙所示。起始压强为10 kPa,丙烷、丙烯随温度变化的物质的量分数曲线分别是______ 、______ (填代号);A点对应的平衡常数
______ kPa( 为以分压表示的平衡常数);B点丙烷的平衡转化率为
为以分压表示的平衡常数);B点丙烷的平衡转化率为______ 。

回答下列问题:
(1)主反应的焓变

 、
、 的体积分数均为30%,则此时
的体积分数均为30%,则此时 的体积分数为
的体积分数为(2)向密闭容器中充入
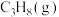 ,发生主反应:
,发生主反应: (忽略副反应的发生)。
(忽略副反应的发生)。①测得反应速率方程为
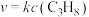 ,k为反应速率常数。已知:
,k为反应速率常数。已知: (R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
②在100 kPa、10 kPa不同起始压强下达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图乙所示。起始压强为10 kPa,丙烷、丙烯随温度变化的物质的量分数曲线分别是

 为以分压表示的平衡常数);B点丙烷的平衡转化率为
为以分压表示的平衡常数);B点丙烷的平衡转化率为
您最近一年使用:0次
名校
解题方法
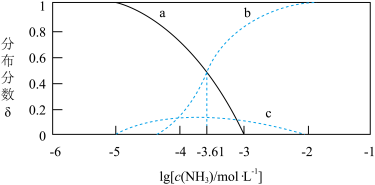
10 . 已知:Ag++NH3 Ag(NH3)+ K1=103.12
Ag(NH3)+ K1=103.12
Ag(NH3)++NH3 [Ag(NH3)2]+ K2
[Ag(NH3)2]+ K2
Ag+、Ag(NH3)+、[Ag(NH3)2]+的分布分数δ与lgc(NH3)关系如图所示,下列说法正确的是
{例如:分布分数δ(Ag+)= }
}
 Ag(NH3)+ K1=103.12
Ag(NH3)+ K1=103.12Ag(NH3)++NH3
 [Ag(NH3)2]+ K2
[Ag(NH3)2]+ K2Ag+、Ag(NH3)+、[Ag(NH3)2]+的分布分数δ与lgc(NH3)关系如图所示,下列说法正确的是
{例如:分布分数δ(Ag+)=
 }
}
| A.曲线c代表[Ag(NH3)2]+ |
| B.K2的数量级为105 |
C.[Ag(NH3)2]+ Ag++2NH3的平衡常数K=10-7.22 Ag++2NH3的平衡常数K=10-7.22 |
| D.当c(NH3)<0.01mol•L-1时,银元素主要以[Ag(NH3)2]+形式存在 |
您最近一年使用:0次
2023-04-30更新
|
271次组卷
|
2卷引用:江西省鹰潭市2023届高三下学期二模理综化学试题



