名校
解题方法
1 . 气候变化是当前人类生存和发展所面临的共同挑战,受到世界各国人民和政府的高度关注。加强对二氧化碳的转化研究显得尤为重要,以下是相关反应:
①

②
 kJ·mol
kJ·mol
③
 kJ·mol
kJ·mol
(1)根据上述反应求:
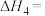
_______ mol 。
。
(2)水煤气变换的反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。_______ 。
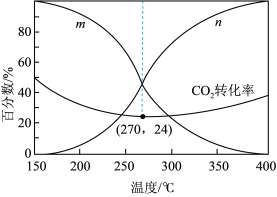
(3)保持在a MPa下,按照投料比 ,当反应达到平衡时,如图所示,其中m和n代表是一氧化碳或甲醇在含碳的产物中物质的量分数。
,当反应达到平衡时,如图所示,其中m和n代表是一氧化碳或甲醇在含碳的产物中物质的量分数。
①请根据图像及相关方程式分析,其中的m曲线代表的物质是_______ (填化学式);
_______  (填“大于”“小于”或者“等于”),请写出判断的理由:
(填“大于”“小于”或者“等于”),请写出判断的理由:_______ ;
③请根据图像计算出270℃时,反应①的 为
为_______ (保留2位有效数字)。
(4)若在恒容绝热的容器中发生反应①,下列情况下一定可以判断反应达到平衡状态的是_______(填标号)。
①


②

 kJ·mol
kJ·mol
③

 kJ·mol
kJ·mol
(1)根据上述反应求:

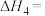
 。
。(2)水煤气变换的反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。

(3)保持在a MPa下,按照投料比
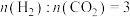 ,当反应达到平衡时,如图所示,其中m和n代表是一氧化碳或甲醇在含碳的产物中物质的量分数。
,当反应达到平衡时,如图所示,其中m和n代表是一氧化碳或甲醇在含碳的产物中物质的量分数。①请根据图像及相关方程式分析,其中的m曲线代表的物质是

 (填“大于”“小于”或者“等于”),请写出判断的理由:
(填“大于”“小于”或者“等于”),请写出判断的理由:③请根据图像计算出270℃时,反应①的
 为
为(4)若在恒容绝热的容器中发生反应①,下列情况下一定可以判断反应达到平衡状态的是_______(填标号)。
| A.容器内的压强不再改变 |
| B.容器内气体密度不再改变 |
C.容器内 |
D.单位时间内,断开 的数目和断开 的数目和断开 的数目相同 的数目相同 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)某温度下, 的平衡常数为9,反应开始时
的平衡常数为9,反应开始时 和
和 的浓度都是
的浓度都是 ,达平衡时
,达平衡时 的转化率为
的转化率为_______ ;该温度下,若起始时c(CO)=0.01 mol∙L-1,c(H2O)=0.02 mol∙L-1,反应一段时间后,测得c(H2)=0.005mol∙L-1,则此时该反应
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)关于反应 △H<0,在一定条件下,反应过程中的速率变化曲线如图:其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是
△H<0,在一定条件下,反应过程中的速率变化曲线如图:其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是_______ (填选项,下同),t2时刻改变的外界条件又可能是_______ 。
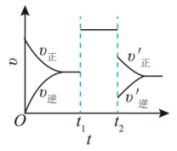
A.加入催化剂 B.压缩容器体积 C.升温 D.降温 E.扩大容器体积 F.恒容下,减少CO的用量 G.恒容下,移走部分CO2
(3)甲酸甲酯( )是一种重要的有机合成中间体,可通过甲醇催化脱氢法制备,其工艺过程包含以下反应:
)是一种重要的有机合成中间体,可通过甲醇催化脱氢法制备,其工艺过程包含以下反应:
反应Ⅰ: K1
K1 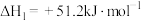
反应Ⅱ: K2
K2 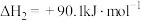
回答下列问题:
①反应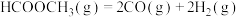 的△H3=
的△H3=_______ kJ∙mol-1,K3=_______ (用K1、K2表示)。
②在400kPa、铜基催化剂存在下,向密闭容器中通入CH3OH进行Ⅰ、Ⅱ两个反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
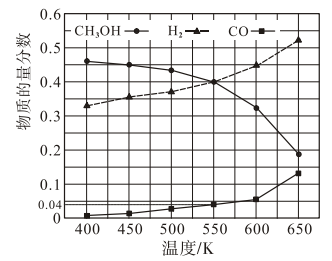
a.随温度升高,CH3OH的平衡组成比例呈现如图所示趋势的原因是_______ 。
b.550K时,反应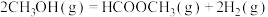 的平衡常数Kp=
的平衡常数Kp=_______  ,CH3OH的平衡转化率为
,CH3OH的平衡转化率为_______ 。(物质 的摩尔分数
的摩尔分数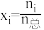 ,气体分压
,气体分压 )
)
c.研究表明,在700K以后升高体系温度,HCOOCH3的产率下降,可能的原因是_______ 。
(1)某温度下,
 的平衡常数为9,反应开始时
的平衡常数为9,反应开始时 和
和 的浓度都是
的浓度都是 ,达平衡时
,达平衡时 的转化率为
的转化率为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)关于反应
 △H<0,在一定条件下,反应过程中的速率变化曲线如图:其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是
△H<0,在一定条件下,反应过程中的速率变化曲线如图:其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是
A.加入催化剂 B.压缩容器体积 C.升温 D.降温 E.扩大容器体积 F.恒容下,减少CO的用量 G.恒容下,移走部分CO2
(3)甲酸甲酯(
 )是一种重要的有机合成中间体,可通过甲醇催化脱氢法制备,其工艺过程包含以下反应:
)是一种重要的有机合成中间体,可通过甲醇催化脱氢法制备,其工艺过程包含以下反应:反应Ⅰ:
 K1
K1 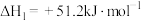
反应Ⅱ:
 K2
K2 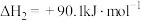
回答下列问题:
①反应
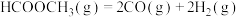 的△H3=
的△H3=②在400kPa、铜基催化剂存在下,向密闭容器中通入CH3OH进行Ⅰ、Ⅱ两个反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

a.随温度升高,CH3OH的平衡组成比例呈现如图所示趋势的原因是
b.550K时,反应
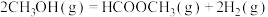 的平衡常数Kp=
的平衡常数Kp= ,CH3OH的平衡转化率为
,CH3OH的平衡转化率为 的摩尔分数
的摩尔分数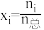 ,气体分压
,气体分压 )
)c.研究表明,在700K以后升高体系温度,HCOOCH3的产率下降,可能的原因是
您最近一年使用:0次
名校
解题方法
3 . 二氧化碳资源化利用是科研的热点, 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:
ⅰ.
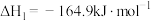
ⅱ.
 ;
;
ⅲ.积炭反应: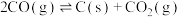
 ;
;
ⅳ.
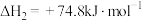 。
。
(1)CO歧化积炭反应在低温下能自发进行,则
______ 0(填“>”或“<”)。
(2)研究表明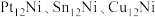 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。
①该历程分______ 步进行,甲烷逐步脱氢过程中活化能最大的反应步骤是:______ (用化学方程式表示)。
② 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:______ 。
(3) 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
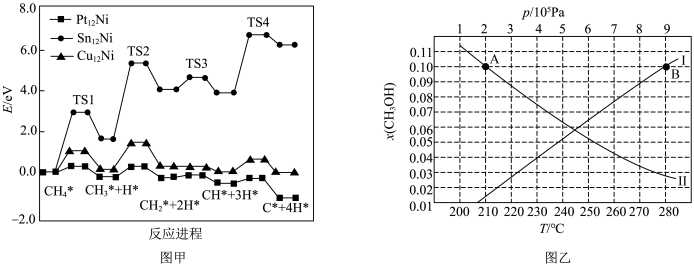
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为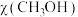 ,在
,在 时
时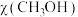 随压强
随压强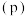 变化关系及在
变化关系及在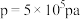 时
时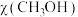 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:
①图中对应等温过程的曲线为______ 。
②图中 两点的速率
两点的速率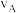
______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③当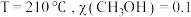 时,
时, 的平衡转化率为
的平衡转化率为______ ; 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
______ (列出计算式)。
 甲烷化技术是重要途径之一,其相关反应如下:
甲烷化技术是重要途径之一,其相关反应如下:ⅰ.

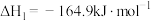
ⅱ.

 ;
;ⅲ.积炭反应:
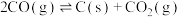
 ;
;ⅳ.

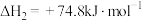 。
。
(1)CO歧化积炭反应在低温下能自发进行,则

(2)研究表明
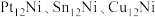 三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中
三种双金属合金团簇均可用于催化反应ⅰ,在催化剂表面涉及多个基元反应,其中 在不同催化剂作用下裂解的反应历程如图甲所示。
在不同催化剂作用下裂解的反应历程如图甲所示。①该历程分
②
 双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:
双金属合金团簇具有良好的抗积碳作用,有效抑制碳积沉对催化剂造成的不良影响,请结合图甲解释原因:(3)
 加氢制甲醇也是
加氢制甲醇也是 资源化利用的重要途径之一,其反应原理为
资源化利用的重要途径之一,其反应原理为
 。投料比
。投料比 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为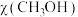 ,在
,在 时
时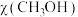 随压强
随压强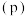 变化关系及在
变化关系及在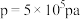 时
时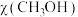 随温度(
随温度( )的曲线变化如图乙所示:
)的曲线变化如图乙所示:①图中对应等温过程的曲线为
②图中
 两点的速率
两点的速率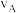
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③当
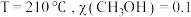 时,
时, 的平衡转化率为
的平衡转化率为 为210℃时,各物质的平衡分压表示反应的平衡常数
为210℃时,各物质的平衡分压表示反应的平衡常数
您最近一年使用:0次
名校
4 . 对于可逆反应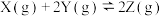
 ,下列图像中正确的是
,下列图像中正确的是
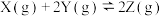
 ,下列图像中正确的是
,下列图像中正确的是 | 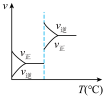 |  | 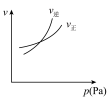 |
| A.反应体系中X的体积分数与时间的关系图 | B.正逆反应速率与温度的关系图 | C.不同温度下X的转化率与时间的关系图 | D.正逆反应速率与压强的关系图 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-12更新
|
243次组卷
|
3卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
解题方法
5 . 工业上利用C2H2制取C2H4的反应为C2H2(g)+H2(g) C2H4(g) △H。回答下列问题:
C2H4(g) △H。回答下列问题:
(1)H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为
CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为______ ,平衡时CH4的转化率为______ 。
(2)对于反应C2H2(g)+H2(g) C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
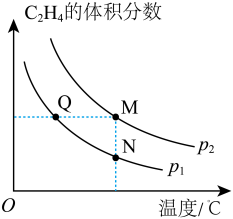
①该反应为______ 反应(填“吸热”或“放热”),压强:p1______ p2(填“>”“=”或“<”)。
②Q、M、N三点的平衡常数KQ、KM、KN的大小关系为______ 。
(3)对于反应C2H2(g)+H2(g) C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是
C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是_____ (填字母)。
a.降低温度 b.使用合适的催化剂
c.缩小容器容积 d.减小原料气中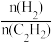 的比值
的比值
 C2H4(g) △H。回答下列问题:
C2H4(g) △H。回答下列问题:(1)H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为
CO(g)+3H2(g)获取。T℃时,向2L恒容密闭容器中充入1.2mol水蒸气和1.2molCH4(g),经过2min反应达平衡,平衡后测得CO的浓度为0.3mol•L-1,则0~2min内H2的平均反应速率为(2)对于反应C2H2(g)+H2(g)
 C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
C2H4(g),其他条件一定时,温度、压强对平衡时混合气体中C2H4体积分数的影响如图所示。
①该反应为
②Q、M、N三点的平衡常数KQ、KM、KN的大小关系为
(3)对于反应C2H2(g)+H2(g)
 C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是
C2H4(g),为了增大反应速率,且增大H2的平衡转化率,下列措施一定可行的是a.降低温度 b.使用合适的催化剂
c.缩小容器容积 d.减小原料气中
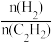 的比值
的比值
您最近一年使用:0次
6 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。
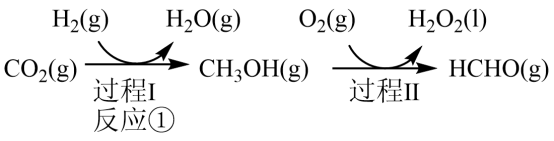
已知:
反应②:
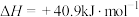 ;
;
反应③:
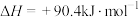 。
。
(1)反应①的热化学方程式为_______ ;若过程II中 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成_______ mol HCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
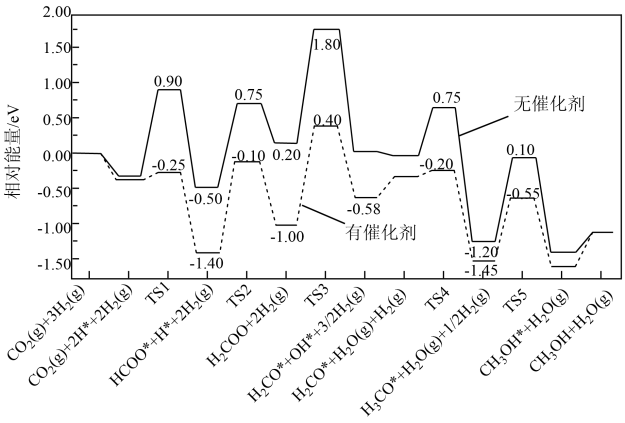
该反应历程中决速步骤的化学方程式为_______ ,催化剂使该步骤的活化能降低_______ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。

i.下列说法正确的是_______ (填标号)。
A.曲线a为等压线,曲线b为等温线
B.增大 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大
C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为_______ kPa,反应①的压强平衡常数
_______  (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
iii.图中M点的 高于N点的原因是
高于N点的原因是_______ 。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一。
人工合成淀粉(节选途径见下图)中的重要反应之一。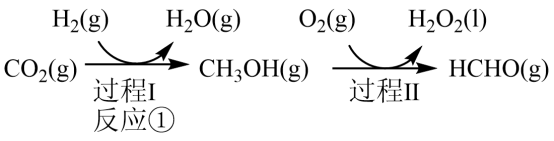
已知:
反应②:

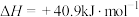 ;
;反应③:

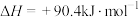 。
。(1)反应①的热化学方程式为
 得到4mol电子,则理论上可生成
得到4mol电子,则理论上可生成(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为
(3)某研究小组采用上述催化剂,向密闭容器中通入
 和
和 ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 随压强p的变化、在p=600kPa下
随压强p的变化、在p=600kPa下 随温度T的变化,如下图所示。
随温度T的变化,如下图所示。
i.下列说法正确的是
A.曲线a为等压线,曲线b为等温线
B.增大
 与
与 的浓度,反应①和反应②的正反应速率都增大
的浓度,反应①和反应②的正反应速率都增大C.反应①的平衡常数:K(X)=K(Y)
D.反应②的正反应速率:v(X)<v(M)
ii.已知M点:容器中
 为
为 ,CO为
,CO为 ,则此时
,则此时 的分压为
的分压为
 (压强平衡常数
(压强平衡常数 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。iii.图中M点的
 高于N点的原因是
高于N点的原因是
您最近一年使用:0次
2022-03-31更新
|
1007次组卷
|
4卷引用:福建省永春第一中学2023届高三下学期期初考试化学试题
福建省永春第一中学2023届高三下学期期初考试化学试题广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第19题 化学反应原理综合题-备战2022年高考化学临考题号押题(广东卷)
名校
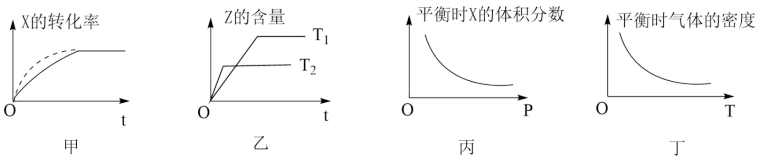
7 . 已知在密闭容器中进行可逆反应: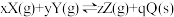
 ,下列对有关该反应的图象判断正确的是
,下列对有关该反应的图象判断正确的是
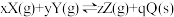
 ,下列对有关该反应的图象判断正确的是
,下列对有关该反应的图象判断正确的是
| A.甲中虚线表示使用了合适的催化剂 |
B.由乙可判断温度: , , |
C.由丙可推知: |
D.由丁可推出: |
您最近一年使用:0次
2022-01-02更新
|
367次组卷
|
2卷引用:甘肃省武威市民勤县第一中学2023-2024学高二下学期开学考试化学试题
8 . 以乙烯、丙烯为代表的低碳烯烃是化学工业的最基本原料。回答下列问题:
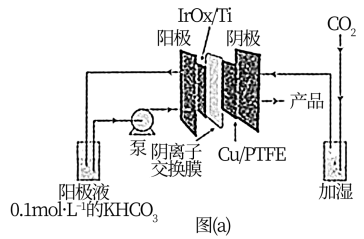
(1)一种电解还原CO2制乙烯的装置如图(a)所示,阴极上生成乙烯的电极反应式为___________ 。
(2)丙烷脱氢制烯烃反应及其常压下平衡常数自然对数值lnKp随温度(T)的变化如图(b)所示:

主反应:
Ⅰ.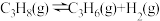
副反应:
Ⅱ.

Ⅲ.
Ⅳ.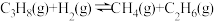

①图中属于吸热反应的是___________ (填标号)。
② =
=___________  。
。
③若只发生反应Ⅱ,则在w点时(若总压强为1MPa)丙烷的转化率为___________ (已知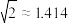 )。
)。
(3)甲醇乙烯烷基化制备丙烯主要反应有:
Ⅰ.

Ⅱ.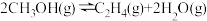
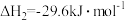
Ⅲ.
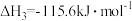
在总压强为0.2MPa,起始时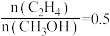 时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的
时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的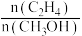 与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
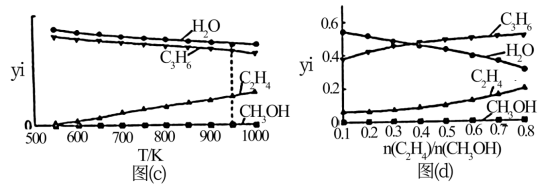
①图(c)中丙烯分压最大值不超过___________ MPa;温度高于550K时,随温度升高,yi(C2H4)不断增大的原因是___________ 。
②图(d)中随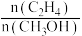 的增大,yi(H2O)不断减小的原因是
的增大,yi(H2O)不断减小的原因是___________ 。
③下列说法正确的是___________ (填字母)。
A.恒温下改变压强,丙烯的平衡产率不变
B.生产丙烯时,升高温度有利于丙烯的生成
C.实际生产中改进催化剂的选择性有利于提高丙烯的产率
D.其它条件不变时,适当增大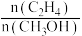 ,有利于提高丙烯的平衡产率
,有利于提高丙烯的平衡产率
(1)一种电解还原CO2制乙烯的装置如图(a)所示,阴极上生成乙烯的电极反应式为

(2)丙烷脱氢制烯烃反应及其常压下平衡常数自然对数值lnKp随温度(T)的变化如图(b)所示:

主反应:
Ⅰ.
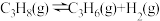
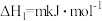
副反应:
Ⅱ.


Ⅲ.

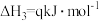
Ⅳ.
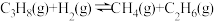

①图中属于吸热反应的是
②
 =
= 。
。③若只发生反应Ⅱ,则在w点时(若总压强为1MPa)丙烷的转化率为
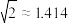 )。
)。(3)甲醇乙烯烷基化制备丙烯主要反应有:
Ⅰ.


Ⅱ.
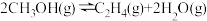
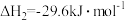
Ⅲ.

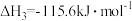
在总压强为0.2MPa,起始时
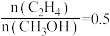 时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的
时,平衡时各物质的物质的量分数(yi)随温度变化如图(c)所示;起始时不同的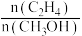 与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
与平衡时各物质的物质的量分数(yi)之间的关系如图(d)所示。
①图(c)中丙烯分压最大值不超过
②图(d)中随
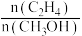 的增大,yi(H2O)不断减小的原因是
的增大,yi(H2O)不断减小的原因是③下列说法正确的是
A.恒温下改变压强,丙烯的平衡产率不变
B.生产丙烯时,升高温度有利于丙烯的生成
C.实际生产中改进催化剂的选择性有利于提高丙烯的产率
D.其它条件不变时,适当增大
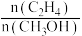 ,有利于提高丙烯的平衡产率
,有利于提高丙烯的平衡产率
您最近一年使用:0次
2021-09-04更新
|
313次组卷
|
2卷引用:湖北省九师联盟2022届高三上学期8月开学考化学试题
9 . 丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。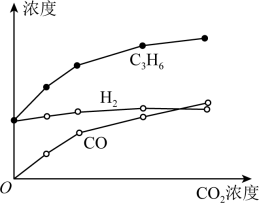
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
| A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol |
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O CO+H2O |
| C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大 |
| D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6) |
您最近一年使用:0次
2021-09-03更新
|
8548次组卷
|
24卷引用:河北省昌黎第一中学2023届高三下学期开学考试化学试题
河北省昌黎第一中学2023届高三下学期开学考试化学试题2021年新高考北京化学高考真题山东省实验中学2022届高三第一次诊断考试化学试题山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷2021年北京高考化学试题变式题11-19黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)章末综合评价(七)北京市第一○一中学2023-2024学年高二上学期期中练习化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题(已下线)选择题16-20北京市第一六一中学2023-2024学年高二上学期期中阶段练习化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 (已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷2024届河北省部分高中高三下学期三模化学试题



