1 . 乙烯是合成多种塑料的单体。我国科学家开发的特殊催化剂用 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。
主反应: 放热反应
放热反应
(1)在容积为2L的恒容密闭容器中充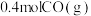 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内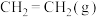 的平均反应速率为
的平均反应速率为___________ 。
(2)在一定温度下,向恒容密闭容器中充入 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是___________ (填编号)。
A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高 平衡转化率的措施是
平衡转化率的措施是___________ (任填一条)。
(3)下列事实中,不能用勒夏特列原理解释的是_______。
(4)下图表示反应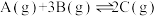 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。主反应:
 放热反应
放热反应(1)在容积为2L的恒容密闭容器中充
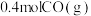 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内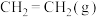 的平均反应速率为
的平均反应速率为(2)在一定温度下,向恒容密闭容器中充入
 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高
 平衡转化率的措施是
平衡转化率的措施是(3)下列事实中,不能用勒夏特列原理解释的是_______。
A.反应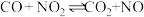 (放热反应),升高温度平衡向逆反应方向移动 (放热反应),升高温度平衡向逆反应方向移动 |
B.采用高压有利于合成氨反应: |
C.使用催化剂有利于合成氨反应: |
D.氯水中有下列平衡: ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
(4)下图表示反应
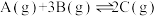 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。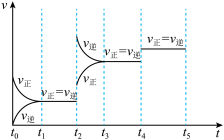
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
2 . 天然气经催化重整转化成合成气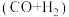 后再合成其他化工产品,既可缓解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:
后再合成其他化工产品,既可缓解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:
反应I:
反应Ⅱ: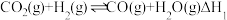
(1)反应I可分为如下两步:
 裂解:
裂解: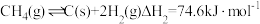
 重整:
重整: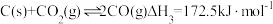
则
_____ 。反应I能够自发进行的条件是_____ ,判断依据是_____ 。
(2)T℃时,向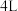 容器中通入
容器中通入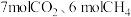 ,发生反应I、Ⅱ。
,发生反应I、Ⅱ。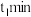 后平衡,体系中
后平衡,体系中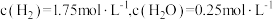 ,压强为p。
,压强为p。
①此温度下,反应I的平衡常数
_____ [对于气相反应,用某组分B的平衡压强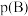 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如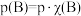 ,p为平衡总压强,
,p为平衡总压强,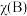 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②请在图中画出 时段,
时段,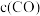 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度_____ 。
(3)二甲醚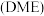 是重要的有机化工原料,可通过上述原料制备,反应方程式为:
是重要的有机化工原料,可通过上述原料制备,反应方程式为:
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是_____ 。
A. 的反应速率之比为
的反应速率之比为
B. 的物质的量之比为
的物质的量之比为
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
② 时,在容积为
时,在容积为 的恒容容器中按体积比
的恒容容器中按体积比 充入总物质的量为
充入总物质的量为 和
和 的混合物,发生上述制备反应,平衡时
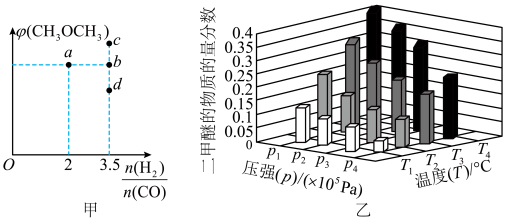
的混合物,发生上述制备反应,平衡时 的体积分数对应下图甲中的a点,若调节起始时物质的量之比为
的体积分数对应下图甲中的a点,若调节起始时物质的量之比为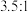 ,则
,则 的平衡体积分数可能对应下图甲中的
的平衡体积分数可能对应下图甲中的_____ (填“b”“c”或“d”)点。
③某温度下,将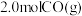 和
和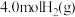 充入容积为
充入容积为 的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中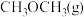 的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是_____ (填序号)。
A.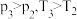 B.
B.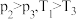 C.
C.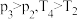 D.
D.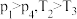
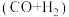 后再合成其他化工产品,既可缓解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:
后再合成其他化工产品,既可缓解能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下二个反应:反应I:

反应Ⅱ:
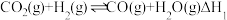
(1)反应I可分为如下两步:
 裂解:
裂解: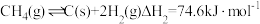
 重整:
重整: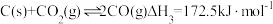
则

(2)T℃时,向
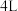 容器中通入
容器中通入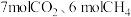 ,发生反应I、Ⅱ。
,发生反应I、Ⅱ。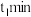 后平衡,体系中
后平衡,体系中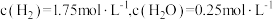 ,压强为p。
,压强为p。①此温度下,反应I的平衡常数

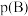 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如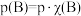 ,p为平衡总压强,
,p为平衡总压强,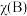 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②请在图中画出
 时段,
时段,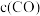 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度
(3)二甲醚
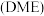 是重要的有机化工原料,可通过上述原料制备,反应方程式为:
是重要的有机化工原料,可通过上述原料制备,反应方程式为:
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是
A.
 的反应速率之比为
的反应速率之比为
B.
 的物质的量之比为
的物质的量之比为
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②
 时,在容积为
时,在容积为 的恒容容器中按体积比
的恒容容器中按体积比 充入总物质的量为
充入总物质的量为 和
和 的混合物,发生上述制备反应,平衡时
的混合物,发生上述制备反应,平衡时 的体积分数对应下图甲中的a点,若调节起始时物质的量之比为
的体积分数对应下图甲中的a点,若调节起始时物质的量之比为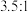 ,则
,则 的平衡体积分数可能对应下图甲中的
的平衡体积分数可能对应下图甲中的
③某温度下,将
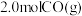 和
和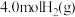 充入容积为
充入容积为 的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中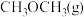 的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如上图乙所示,关于温度和压强的关系判断正确的是A.
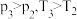 B.
B.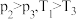 C.
C.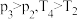 D.
D.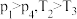
您最近一年使用:0次
名校
解题方法
3 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为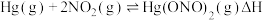
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

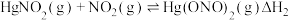

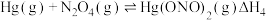
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为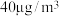 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中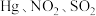 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于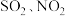 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

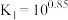
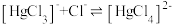
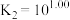
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随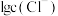 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为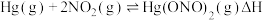
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
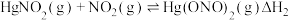

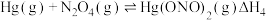
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
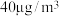 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
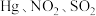 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于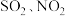 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是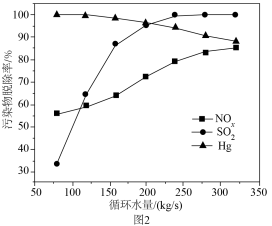
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
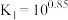
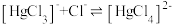
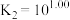
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随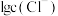 的变化如图所示
的变化如图所示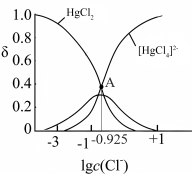
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
解题方法
4 . 煤的气化、液化和焦化是煤综合利用的主要方法。利用这些加工手段可以从煤中获得多种化工原料,用于进一步的化工生产。
(1)煤的气化发生的主要反应是: 。
。
已知: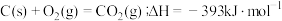
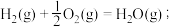

CO(g)+ O2(g)=CO2(g);
O2(g)=CO2(g);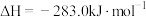
煤气化时发生主要反应的热化学方程式是___________ 。
(2)用煤气化后得到的 合成氨:
合成氨: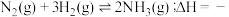
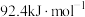 。一定温度下,在容积为
。一定温度下,在容积为 的密闭容器中充入
的密闭容器中充入 和
和 充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
(3)如图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中
的体积分数随温度或压强变化的曲线,图中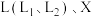 分别代表温度或压强。其中X代表的是
分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断
___________  (填“>”或“<”),理由是
(填“>”或“<”),理由是___________ 。
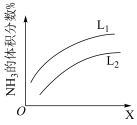
(4)某温度时合成甲醇的反应
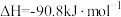 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率
___________ 。
②该温度下的平衡常数___________ 。(可用分数表示)
(1)煤的气化发生的主要反应是:
 。
。已知:
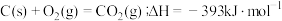
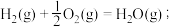

CO(g)+
 O2(g)=CO2(g);
O2(g)=CO2(g);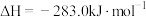
煤气化时发生主要反应的热化学方程式是
(2)用煤气化后得到的
 合成氨:
合成氨: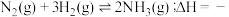
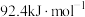 。一定温度下,在容积为
。一定温度下,在容积为 的密闭容器中充入
的密闭容器中充入 和
和 充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。A. 和 和 的物质的量之比不变 的物质的量之比不变 | B.容器内压强不变 |
C. 键断裂的同时,有 键断裂的同时,有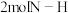 键形成 键形成 | D.氨气的体积分数不变 |
(3)如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中
的体积分数随温度或压强变化的曲线,图中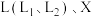 分别代表温度或压强。其中X代表的是
分别代表温度或压强。其中X代表的是
 (填“>”或“<”),理由是
(填“>”或“<”),理由是
(4)某温度时合成甲醇的反应

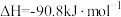 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示: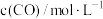 | 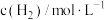 |  | |
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | 0.5 | |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |

②该温度下的平衡常数
您最近一年使用:0次
解题方法
5 .  是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。
(1)在催化剂作用下,可用 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:
则
___________  。
。
(2)在刚性密闭容器中, 平衡时的体积分数随投料比
平衡时的体积分数随投料比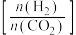 的变化如图所示:
的变化如图所示:
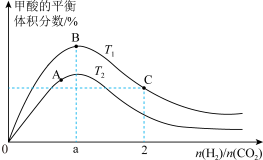
①图中 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②A、B、C三点 的平衡转化率
的平衡转化率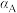 、
、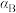 、
、 ,由大到小的顺序为
,由大到小的顺序为___________ 。
(3) 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中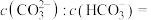
___________ 。(室温下,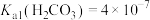 ,
,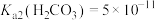 )。
)。
(4)二氧化碳的重整利用的另一方式为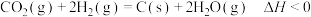 。
。
在250℃时,向体积为2L恒容密闭容器中通入 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
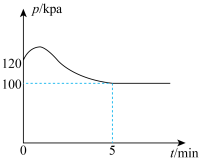
①为提高平衡时 的转化率,反应条件应选择
的转化率,反应条件应选择___________ (填标号)。
A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数
___________ 。
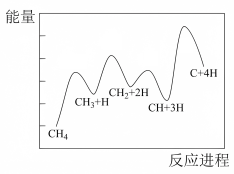
(5)一定条件下, 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第___________ 步反应。
 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。(1)在催化剂作用下,可用
 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:| 共价键 |  |  |  |  |  |
键能 | 799 | 343 | 436 | 463 | 413 |

 。
。(2)在刚性密闭容器中,
 平衡时的体积分数随投料比
平衡时的体积分数随投料比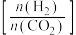 的变化如图所示:
的变化如图所示:
①图中
 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②A、B、C三点
 的平衡转化率
的平衡转化率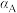 、
、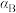 、
、 ,由大到小的顺序为
,由大到小的顺序为(3)
 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中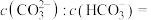
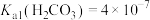 ,
,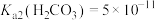 )。
)。(4)二氧化碳的重整利用的另一方式为
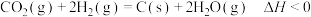 。
。在250℃时,向体积为2L恒容密闭容器中通入
 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
①为提高平衡时
 的转化率,反应条件应选择
的转化率,反应条件应选择A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数

(5)一定条件下,
 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
您最近一年使用:0次
解题方法
6 . 氨是重要的化工原料,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)二十世纪初,工业以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
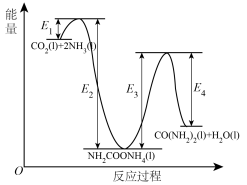
①反应a为反应_____ (填“放热”或“吸热”)。
②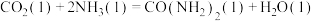

_____ kJ/mol(用含“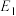 、
、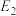 、
、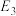 、
、 ”的代数式表示)。
”的代数式表示)。
(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
(i)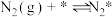
(ii)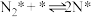
(iii)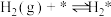
(iv)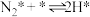
(v)
……
(…)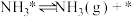
实际生产中, 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:
①_____ ;②_____ 。
(3)若在不同压强下,以投料比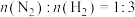 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: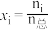 )
)
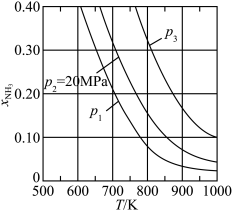
①图中压强由小到大的顺序为_____ 。
②当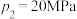 、
、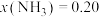 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=_____ (保留到小数点后一位)。
③某温度下,在1L的密闭容器中充入 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得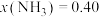 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为_____ 。
(1)二十世纪初,工业以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
①反应a为反应
②
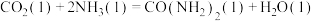

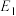 、
、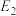 、
、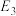 、
、 ”的代数式表示)。
”的代数式表示)。(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位,
 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。(i)
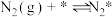
(ii)
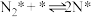
(iii)
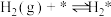
(iv)
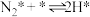
(v)

……
(…)
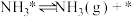
实际生产中,
 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:①
(3)若在不同压强下,以投料比
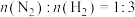 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: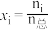 )
)
①图中压强由小到大的顺序为
②当
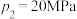 、
、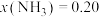 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=③某温度下,在1L的密闭容器中充入
 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得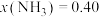 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为
您最近一年使用:0次
7 .  是存在于燃气中的一种有害气体,脱除
是存在于燃气中的一种有害气体,脱除 的方法有多种。回答下列问题:
的方法有多种。回答下列问题:
(1)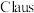 氧化回收硫的反应原理为:
氧化回收硫的反应原理为:
i: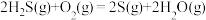
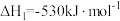 ;
;
ii: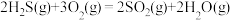
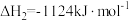
iii: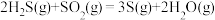

①根据盖斯定律,反应iii中的
______  。
。
②化学反应的焓变与反应物和生成物的键能(气态分子中 化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:
化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:
结合(1)中反应原理a=___________ 。
(2)电解法治理 是先用
是先用 溶液吸收含
溶液吸收含 的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
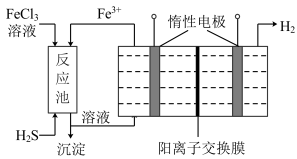
①进入电解池的溶液中,溶质是______ (填化学式)。
②阳极的电极反应式为_________ 。
(3)天然气中含有 杂质,某科研小组用氨水吸收得到
杂质,某科研小组用氨水吸收得到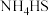 溶液,已知
溶液,已知 时,
时,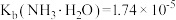 ,
,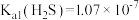 ,
,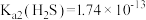 ,
,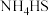 溶液中所含粒子浓度大小关系正确的是_______(填字母)。
溶液中所含粒子浓度大小关系正确的是_______(填字母)。
(4)工业上采用高温热分解 的方法制取
的方法制取 ,在膜反应器中分离出
,在膜反应器中分离出 。
。 下,
下, 分解:
分解: 。保持压强不变,反应达到平衡时,气体的体积分数
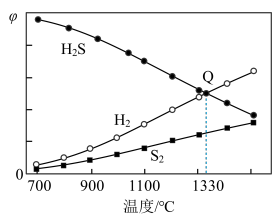
。保持压强不变,反应达到平衡时,气体的体积分数 随温度的变化曲线如图:
随温度的变化曲线如图:
①在密闭容器中,关于上述反应的说法正确的是______ (填字母)。
A. 随温度的升高而增大
随温度的升高而增大
B.低压有利于提高 的平衡分解率
的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点: 的平衡转化率为
的平衡转化率为______ ; 时,反应
时,反应 的
的
______  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
 是存在于燃气中的一种有害气体,脱除
是存在于燃气中的一种有害气体,脱除 的方法有多种。回答下列问题:
的方法有多种。回答下列问题:(1)
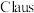 氧化回收硫的反应原理为:
氧化回收硫的反应原理为:i:
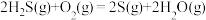
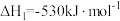 ;
;ii:
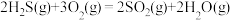
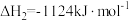
iii:
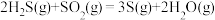

①根据盖斯定律,反应iii中的

 。
。②化学反应的焓变与反应物和生成物的键能(气态分子中
 化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:
化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:| 共价键 | 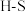 |  | 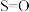 |  |
键能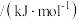 | 339 | 246 | a | 120 |
(2)电解法治理
 是先用
是先用 溶液吸收含
溶液吸收含 的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
①进入电解池的溶液中,溶质是
②阳极的电极反应式为
(3)天然气中含有
 杂质,某科研小组用氨水吸收得到
杂质,某科研小组用氨水吸收得到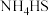 溶液,已知
溶液,已知 时,
时,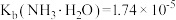 ,
,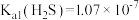 ,
,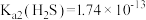 ,
,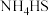 溶液中所含粒子浓度大小关系正确的是_______(填字母)。
溶液中所含粒子浓度大小关系正确的是_______(填字母)。A.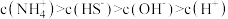 | B. |
C.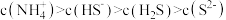 | D.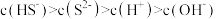 |
(4)工业上采用高温热分解
 的方法制取
的方法制取 ,在膜反应器中分离出
,在膜反应器中分离出 。
。 下,
下, 分解:
分解: 。保持压强不变,反应达到平衡时,气体的体积分数
。保持压强不变,反应达到平衡时,气体的体积分数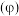 随温度的变化曲线如图:
随温度的变化曲线如图:
①在密闭容器中,关于上述反应的说法正确的是
A.
 随温度的升高而增大
随温度的升高而增大B.低压有利于提高
 的平衡分解率
的平衡分解率C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则
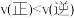
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:
 的平衡转化率为
的平衡转化率为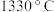 时,反应
时,反应 的
的
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解题方法
8 . 碳中和作为一种新型环保形式可推动全社会绿色发展,科学家正在研究建立如下图所示的二氧化碳新循环体系。回答下列问题:
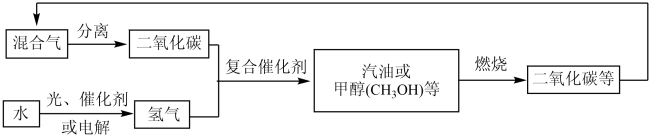
(1)结合图示,下列说法不正确的是_______(填字母)。
(2)300℃时,向2L的恒容密闭容器中,充入2mol  (g)和2mol
(g)和2mol  (g)使之发生反应:
(g)使之发生反应:
 ,测得各物质的物质的量浓度随时间的变化如图所示:
,测得各物质的物质的量浓度随时间的变化如图所示:
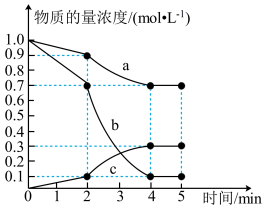
①由图可知,曲线_______ (填“a”、“b”或“c”)表示 浓度随时间的变化;0~2min内,
浓度随时间的变化;0~2min内,
_______  。
。
②已知:反应至2min时,改变了某一反应条件。由图可知,0~2min内 (g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是
(g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是_______ (填字母)。
A.加入催化剂 B.升高温度 C.降低温度 D.增加 的物质的量
的物质的量
③下列能判断该反应已达到化学平衡的标志是_______ (填字母)。
A.容器中混合气体的密度保持不变
B.容器中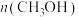 不再发生变化
不再发生变化
C.容器中混合气体的平均摩尔质量保持不变
D.单位时间内消耗1mol 的同时生成1mol
的同时生成1mol 

(1)结合图示,下列说法不正确的是_______(填字母)。
| A.甲醇燃烧时化学能全部转化为热能 | B.光能(或电能)可以转化为化学能 |
| C.减少碳排放有利于缓解全球变暖 | D.无机物和有机物可以相互转化 |
 (g)和2mol
(g)和2mol  (g)使之发生反应:
(g)使之发生反应:
 ,测得各物质的物质的量浓度随时间的变化如图所示:
,测得各物质的物质的量浓度随时间的变化如图所示:
①由图可知,曲线
 浓度随时间的变化;0~2min内,
浓度随时间的变化;0~2min内,
 。
。②已知:反应至2min时,改变了某一反应条件。由图可知,0~2min内
 (g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是
(g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是A.加入催化剂 B.升高温度 C.降低温度 D.增加
 的物质的量
的物质的量③下列能判断该反应已达到化学平衡的标志是
A.容器中混合气体的密度保持不变
B.容器中
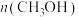 不再发生变化
不再发生变化C.容器中混合气体的平均摩尔质量保持不变
D.单位时间内消耗1mol
 的同时生成1mol
的同时生成1mol 
您最近一年使用:0次
名校
解题方法
9 . 已知反应:
反应①: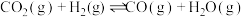
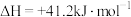
反应②: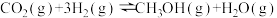
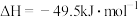
反应③:
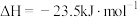
在2 MPa,起始投料 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。

(1)①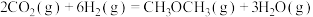 ΔH=
ΔH=___________
②从453-553℃,升高温度CO2平衡转化率降低的原因是___________ 。
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是___________ 。
(2)在催化剂作用下,二甲醚还原NO的反应原理为 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
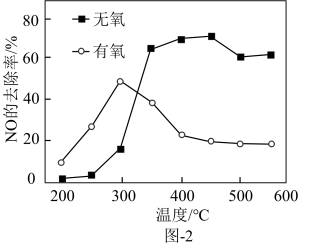
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是___________ 。
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有___________ 。
反应①:
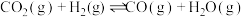
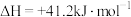
反应②:
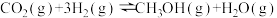
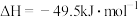
反应③:

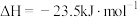
在2 MPa,起始投料
 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
(1)①
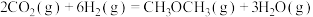 ΔH=
ΔH=②从453-553℃,升高温度CO2平衡转化率降低的原因是
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是
(2)在催化剂作用下,二甲醚还原NO的反应原理为
 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有
您最近一年使用:0次
名校
解题方法
10 . 氮是地球上含量丰富的一种元素,氮及其化合物是科学研究的重点内容:在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
请回答下列问题:
(1)试比较K1、K2的大小,K1___________ K2(填“>”、“=”或“<”)。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.3v正(N2)=v逆(H2)
c.v正(NH3)=v逆(NH3)
d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=___________ 。当测得NH3、N2、H2的浓度分别为3mol⋅L−1、2mol⋅L−1、1mol⋅L−1时,则该反应的v正(N2)___________ v逆(N2)(填“>”、“=”或“<”)。
(4)下图为一定温度下,N2和H2以1:3进行反应,平衡时,NH3的体积分数随压强的变化示意图
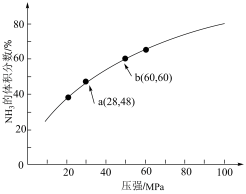
①随压强增大,NH3的体积分数增大的原因是___________ 。
②比较b点和a点:平衡常数K(a)___________ K(b)(填“>”、“<”或“=”,下同),N2的浓度c(a)___________ c(b)。
③计算b点的平衡常数Kp=___________ (Mpa)-2(用分压表示的平衡常数,结果保留2位有效数字)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2)下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.3v正(N2)=v逆(H2)
c.v正(NH3)=v逆(NH3)
d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=(4)下图为一定温度下,N2和H2以1:3进行反应,平衡时,NH3的体积分数随压强的变化示意图

①随压强增大,NH3的体积分数增大的原因是
②比较b点和a点:平衡常数K(a)
③计算b点的平衡常数Kp=
您最近一年使用:0次
2023-06-07更新
|
793次组卷
|
2卷引用:广东省华南师范大学附属中学2022-2023学年高二上学期1月期末化学试题



