名校
1 . 下图(左)表示1-甲基萘(1-MN)加氢饱和反应网络,四个加氢反应均为放热反应(用反应1、2、3、4表示)。下图(右)表示反应温度(T)对平衡时反应体系中有机化合物物质的量分数(x/%)的影响(6MPa,1-MN和 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法不正确 的是
 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法 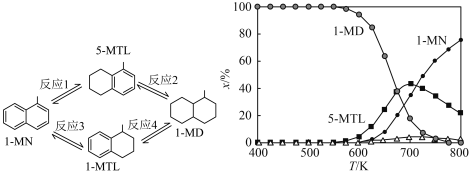
| A.800K反应2和反应4生成1-MD的程度很小 |
| B.600K到800K,反应1的平衡常数逐渐减小 |
| C.700K反应1的平衡常数小于反应3的平衡常数 |
| D.600K到650K,反应2中5-MTL增加的量大于反应1中5-MTL减少的量 |
您最近一年使用:0次
名校
解题方法
2 . 工业上利用碳热还原 制得
制得 ,进而生产各种含钡化合物。温度对反应后组分的影响如下图。已知:碳热还原
,进而生产各种含钡化合物。温度对反应后组分的影响如下图。已知:碳热还原 过程中可能发生下列反应
过程中可能发生下列反应
ⅰ.
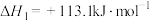
ⅱ.
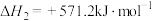
ⅲ.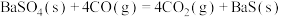
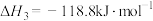

关于碳热还原 的过程,下列说法正确的是
的过程,下列说法正确的是
 制得
制得 ,进而生产各种含钡化合物。温度对反应后组分的影响如下图。已知:碳热还原
,进而生产各种含钡化合物。温度对反应后组分的影响如下图。已知:碳热还原 过程中可能发生下列反应
过程中可能发生下列反应ⅰ.

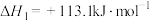
ⅱ.

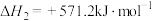
ⅲ.
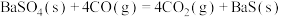
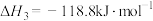

关于碳热还原
 的过程,下列说法正确的是
的过程,下列说法正确的是A.制 的最佳温度应控制在1000℃ 的最佳温度应控制在1000℃ |
| B.400℃之前一定不会发生反应ⅱ |
C.400℃后,反应后组分的变化可能与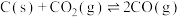 有关 有关 |
D.反应过程中,生成的 和CO的物质的量之和始终等于投入C的物质的量 和CO的物质的量之和始终等于投入C的物质的量 |
您最近一年使用:0次
名校
解题方法
3 . 对于反应: ,下列图像正确的是
,下列图像正确的是
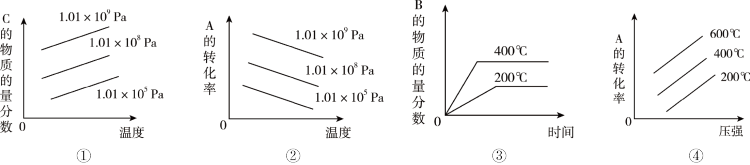
 ,下列图像正确的是
,下列图像正确的是
| A.①④ | B.②③ | C.①③ | D.②④ |
您最近一年使用:0次
2022-11-12更新
|
227次组卷
|
2卷引用:北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . 温度为T时,在2 L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误 的是
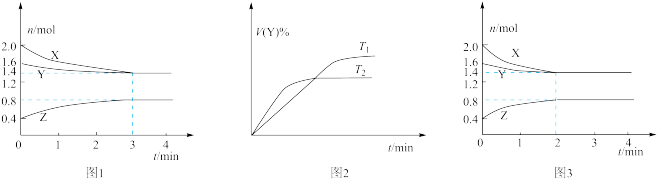

A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| C.反应进行的前3 min内,用X表示的反应速率v(X)=0.1 mol·L-1·min-1 |
| D.保持其他条件不变,升高温度,平衡逆向移动 |
您最近一年使用:0次
2022-10-22更新
|
78次组卷
|
6卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高二上学期10月月考化学试题(已下线)09-10年万州二中高二下学期期末考试化学卷(已下线)2011届四川省资阳市资阳中学高三第一次高考模拟(理综)化学部分(已下线)2013-2014黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2014~2015学年江西四校9月联考高二化学试卷
5 . 对于2A(g)+B(g) 2C(g) △H<0,下列图象正确的是
2C(g) △H<0,下列图象正确的是
 2C(g) △H<0,下列图象正确的是
2C(g) △H<0,下列图象正确的是A.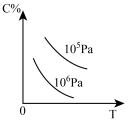 | B.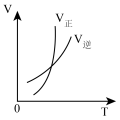 | C.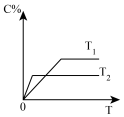 | D. |
您最近一年使用:0次
名校
解题方法
6 . 下列叙述与图像相符的是
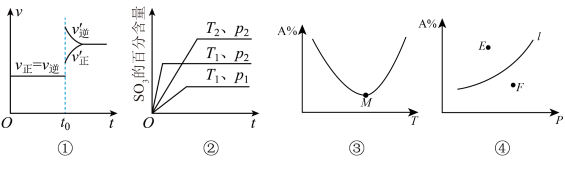

A.图①表示反应2SO2(g)+O2(g) 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 |
B.图②可满足反应2SO2(g)+O2(g) 2SO3(g) ΔH<0 2SO3(g) ΔH<0 |
C.图③表示反应aA(g)+bB(g) cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 |
D.图④表示反应aA(g)+bB(g) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) |
您最近一年使用:0次
2021-11-23更新
|
837次组卷
|
9卷引用:北京市第五十五中学2021-2022学年高二上学期期中考试化学试题
北京市第五十五中学2021-2022学年高二上学期期中考试化学试题北京市第五十五中学2022-2023学年高二上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期期中练习化学试题浙江省杭州地区(含周边)重点中学2021-2022学年高二上学期期中联考化学试题浙江省金华第一中学2021-2022学年高一上学期领军班期末联考化学试题(已下线)专题24 化学平衡图像题的突破-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)浙江省金华一中(领军班)2021-2022学年高一上学期期末化学试题河南省兰考县第二高级中学2021-2022学年高二上学期第三次考试化学试题甘肃省张掖市2022-2023学年高二下学期第一次全市联考化学试题
7 . 丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。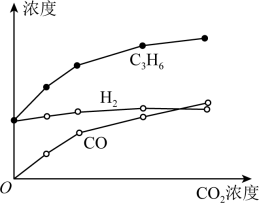
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
| A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol |
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O CO+H2O |
| C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大 |
| D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6) |
您最近一年使用:0次
2021-09-03更新
|
8056次组卷
|
24卷引用:2021年新高考北京化学高考真题
2021年新高考北京化学高考真题2021年北京高考化学试题变式题11-19北京市第一○一中学2023-2024学年高二上学期期中练习化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京市第一六一中学2023-2024学年高二上学期期中阶段练习化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 (已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷山东省实验中学2022届高三第一次诊断考试化学试题山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题河北省昌黎第一中学2023届高三下学期开学考试化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)章末综合评价(七)(已下线)选择题16-202024届河北省部分高中高三下学期三模化学试题
名校
解题方法
8 . 可逆反应: 2 A(g)+B(g) ⇌ 3 C(g) +D(g)。试根据下图判断正确的是
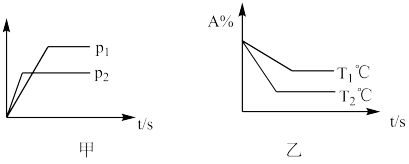

| A.甲图纵轴可以表示混合气体的平均相对分子质量 |
| B.甲图纵轴可以表示 A 的转化率 |
| C.温度 T1℃比 T2℃高 |
| D.正反应为放热反应 |
您最近一年使用:0次
2020-10-29更新
|
305次组卷
|
4卷引用:北京十四中2022-2023学年高二上学期期中检测化学试题
名校
解题方法
9 . 已知反应:A(g)+B(g) C(g)+D(g),在一定压强下,按x=
C(g)+D(g),在一定压强下,按x= (A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数(V%)与温度(T)、x的关系。图乙表示x=2时,正逆反应的平衡常数与温度的关系。则下列说法正确的是
(A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数(V%)与温度(T)、x的关系。图乙表示x=2时,正逆反应的平衡常数与温度的关系。则下列说法正确的是

 C(g)+D(g),在一定压强下,按x=
C(g)+D(g),在一定压强下,按x= (A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数(V%)与温度(T)、x的关系。图乙表示x=2时,正逆反应的平衡常数与温度的关系。则下列说法正确的是
(A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数(V%)与温度(T)、x的关系。图乙表示x=2时,正逆反应的平衡常数与温度的关系。则下列说法正确的是
| A.图甲中,x2<1 |
| B.图乙中,A线表示正反应的平衡常数 |
| C.由图乙可知,T1时,K=1,B的转化率约为33.3% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将减小 |
您最近一年使用:0次
2020-09-25更新
|
940次组卷
|
12卷引用:北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题
北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题河南省洛阳市豫西名校2020-2021学年高二上学期第一次联考化学试题湖北随州市第一中学2020-2021学年高二上学期期中考试化学试题山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)河北省保定市定州市2021-2022学年高二上学期期中考试化学试题专题强化练4 化学反应速率与化学平衡图像四川省成都市树德中学2022-2023学年高二上学期期中考试化学试题辽宁省沈阳市第二中学2023届高三第五次模拟考试化学试题河南省焦作市武陟县第一中学2022-2023学年高二下学期6月期末考试化学试题河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题陕西省学林高中系列联考2023-2024学年高二上学期11月期中化学试题
解题方法
10 . 已知某可逆反应mA(g) + nB(g)  pC(g)△H在密闭容器中进行反应, 测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示,下列判断正确的是
pC(g)△H在密闭容器中进行反应, 测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示,下列判断正确的是
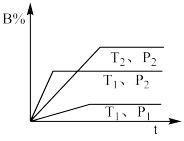
 pC(g)△H在密闭容器中进行反应, 测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示,下列判断正确的是
pC(g)△H在密闭容器中进行反应, 测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示,下列判断正确的是
| A.T1<T2,P1>P2,m+n>p,ΔH<0 |
| B.T1>T2,P2>P1,m+n<p,ΔH >0 |
| C.T2>T1,P2>P1,m+n<p,ΔH<0 |
| D.T1>T2,P2>P1,m+n>p,ΔH>0 |
您最近一年使用:0次
2020-09-18更新
|
135次组卷
|
3卷引用:北京市第四十三中学2021-2022学年高二上学期期中考试化学试题



