名校
解题方法
1 . 汽车尾气中含有 CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
Ⅰ.已知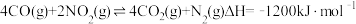
(1)该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度 T1>T2),下列图象正确的是 ___________(填标号)。
(3)某实验小组模拟上述净化过程,一定温度下,在 2L 的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___________ 乙(填“>、=、<或不确定”,下同)。
②甲中 CO 的转化率为 50%,该反应的平衡常数为___________ 。
Ⅱ.柴油汽车尾气中的碳烟(C)和 NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与 NO 的相关数据结果如图所示。
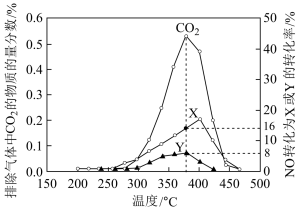
(4)375℃时,测得排出的气体中含 amol O2和 0.0525 mol CO2,已知 X 为 N2,Y 为 N2O,则 a=___________ 。
(5)实验过程中采用 NO 模拟 NOx,而不采用 NO2的原因是___________ 。
Ⅰ.已知
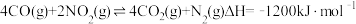
(1)该反应在
(2)对于该反应,改变某一反应条件(温度 T1>T2),下列图象正确的是 ___________(填标号)。
A. | B.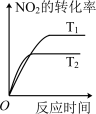 |
C.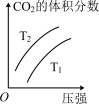 | D.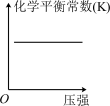 |
①N2的平衡体积分数:甲
②甲中 CO 的转化率为 50%,该反应的平衡常数为
Ⅱ.柴油汽车尾气中的碳烟(C)和 NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与 NO 的相关数据结果如图所示。

| 模拟尾气 | 气体(10mol) | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量(mol) | 0.025 | 0.5 | 9.475 | 一定量 |
(5)实验过程中采用 NO 模拟 NOx,而不采用 NO2的原因是
您最近一年使用:0次
2023-09-19更新
|
111次组卷
|
2卷引用:河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
2 . 含氮污染物的有效去除和资源的充分利用是重要研究课题,回答下列问题:
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为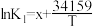 、
、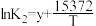 、
、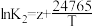 ,其中x、y、z为常数。
,其中x、y、z为常数。
①K1=________ (用含K2、K3的等式表示)。
②反应△H2________ 0 (填>或<),反应Ⅰ________ (填“高温“、“低温”或“任意温度”)下能自发进行。
③平衡常数与温度的函数关系式和②中一致,则 的取值范围是
的取值范围是________ 。(填序号)
A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性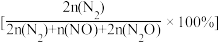 与温度的关系如图所示。
与温度的关系如图所示。
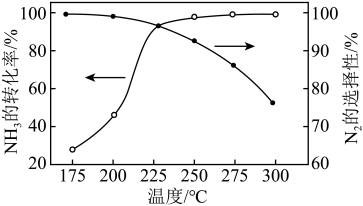
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量____ (填“增大”或“减小“)。
②综合上述信息,需研发________ (填“高温“或“低温“)下N2选择性和催化效果更高的催化剂,能更有效除去尾气中的NH3。
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
200℃时,该反应的化学平衡常数Kp=_______ (kPa)-1[Kp表示平衡常数计算表达式中用分压代替浓度计算所得的值],该反应的△H_________ 0(填“>“或“<“)。
(1)利用工业尾气NO2与O3反应制备新型硝化剂N2O5,过程涉及以下反应:
Ⅰ.2O3(g)=3O2(g)△H1 平衡常数为K1
Ⅱ.4NO2(g)+O2(g)=2N2O5(g)△H2 平衡常数为K2
Ⅲ.2NO2(g)+O3(g)=N2O5(g)+O2(g)△H3平衡常数为K3
平衡常数K与温度T的函数关系为
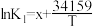 、
、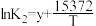 、
、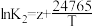 ,其中x、y、z为常数。
,其中x、y、z为常数。①K1=
②反应△H2
③平衡常数与温度的函数关系式和②中一致,则
 的取值范围是
的取值范围是A.<-2 B.-2~0 C.0~2 D.>2
(2)NH3与O2作用分别生成N2、NO和N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去,将一定比例的NH3和N2的混合气体以一定的流速通过装有催化剂的反应管,NH3的转化率、N2的选择性
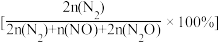 与温度的关系如图所示。
与温度的关系如图所示。
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化合物的含量
②综合上述信息,需研发
(3)在催化剂条件下发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)可消除NO和CO对环境的污染。为探究温度对该反应的影响,实验初始体系中气体分压p(CO)=p(NO)且p(CO2)=2p(N2),测得反应体系中CO和N2的分压随时间变化情况如表所示。
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| 200℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
| 300℃ | CO的分压/kPa | 100 | 69.0 | 48 | 48 | 48 |
| N2的分压/kPa | 10 | 25.5 | 36 | 36 | 36 | |
您最近一年使用:0次
3 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
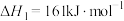
碳氯化:
反应Ⅱ: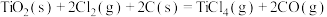
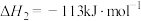
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
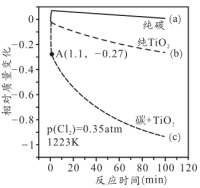
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照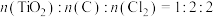 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照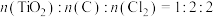 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
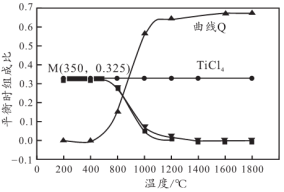
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

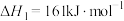
碳氯化:
反应Ⅱ:
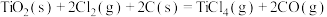
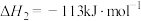
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
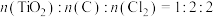 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
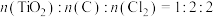 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
4 . 化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为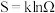 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):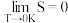
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: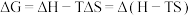
因此有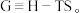 在压强与温度恒定时,若
在压强与温度恒定时,若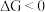 则正反应自发,若
则正反应自发,若 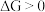 则逆反应自发,若
则逆反应自发,若 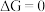 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
 )的定义式为
)的定义式为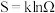 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):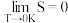
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: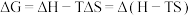
因此有
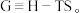 在压强与温度恒定时,若
在压强与温度恒定时,若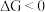 则正反应自发,若
则正反应自发,若 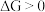 则逆反应自发,若
则逆反应自发,若 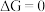 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于| A.其反应熵变很小 |
| B.其反应需要的温度较高 |
| C.反应活化能较低 |
D.反应的体积功大(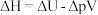 ,其中 ,其中 为其体积功) 为其体积功) |
您最近一年使用:0次
名校
解题方法
5 . 为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s) CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s) CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)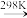 CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________ kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________ 。
(3)为什么反应①和②需要高温,反应③只需常温__________ (已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
① CaCO3(s)
 CaO(s)+CO2(g)
CaO(s)+CO2(g)② CaO(s)+3C(s)
 CaC2(s)+CO(g)
CaC2(s)+CO(g)③ CaC2(s)+H2O(l)
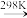 CaO(s)+C2H2(g)
CaO(s)+C2H2(g)(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由
(3)为什么反应①和②需要高温,反应③只需常温
您最近一年使用:0次
名校
6 . 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________ .
②过程(Ⅰ)和过程(Ⅱ)的反应热________ (填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________ .
b.N2的平衡转化率为________ .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________ (填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____ (用含a、c的代数式表示),K3=_____ (用K1和K2表示).反应Ⅲ中的ΔS______ (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
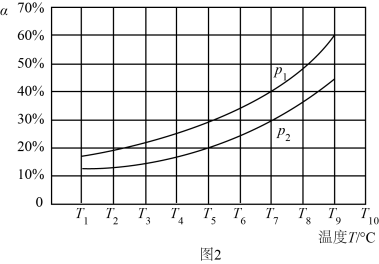
①分析得p1________ p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________ (填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
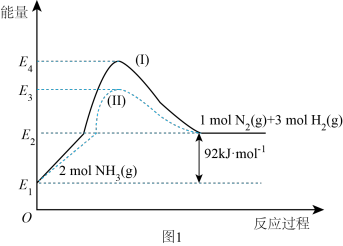
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(Ⅰ)和过程(Ⅱ)的反应热
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为
b.N2的平衡转化率为
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3则反应Ⅱ中的b=
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:

①分析得p1
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
2019-04-28更新
|
1183次组卷
|
7卷引用:【全国百强校】四川省阆中中学2018-2019学年高二下学期期中考试化学试题
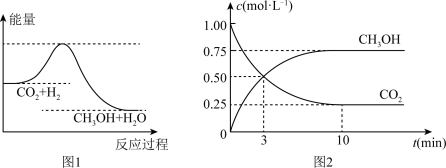
7 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是__________ 。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)容积一定,下列情况不能说明该反应一定达到平衡的是___________________________________ 。
A.混合气体的平均平均相对分子质量不变
B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol H—O键
D.混合气体中c (CO2) : c (H2) =" 1" : 3
(3)温度降低,平衡常数K____________ (填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH (g)的浓度随时间变化如图2所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为______________ mol·L-1·min-1, CO2和H2的转化率比是_________ :
(5)下列措施中能使(4)题中n(CH3OH)/n(CO2)增大的 有___________ 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1molCO2和3molH2
(6)若在另一个密闭容器中充入1molCO2和3molH2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数________ (4)题中的CO2的体积百分数。(“>”或“<”或“=”,下同)
 CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0

(2)容积一定,下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变
B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol H—O键
D.混合气体中c (CO2) : c (H2) =" 1" : 3
(3)温度降低,平衡常数K
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH (g)的浓度随时间变化如图2所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为
(5)下列措施中能使(4)题中n(CH3OH)/n(CO2)增大的 有
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1molCO2和3molH2
(6)若在另一个密闭容器中充入1molCO2和3molH2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数
您最近一年使用:0次
2016-12-09更新
|
572次组卷
|
3卷引用:2014-2015江西省德镇市高二上学期期末化学试卷



