22-23高二上·全国·课时练习
1 . 判断电离方程式的正误并改正。
(1)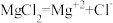
_________ 。
(2)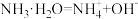
_________ 。
(1)
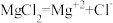
(2)
您最近一年使用:0次
22-23高二上·全国·课时练习
2 . 有关电离平衡的理解不正确的是
| A.电解质在溶液中达到电离平衡时,分子浓度和离子的浓度相等 |
| B.电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变 |
| C.电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行 |
| D.改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡 |
您最近一年使用:0次
3 . 现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于弱电解质的是_______ (填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______ 。
(7)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
a.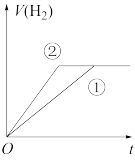 b.
b. 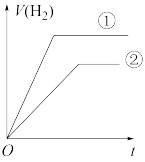 c.
c. 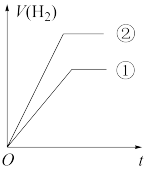 d.
d. 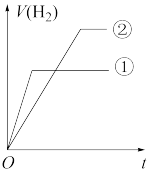
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是_______(填序号)
| A.乙酸和水能以任意比例混溶 |
| B.在乙酸水溶液中含有未电离的乙酸分子 |
| C.乙酸与Na2CO3溶液反应放出CO2气体 |
| D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色 |
(7)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d. 
您最近一年使用:0次
2022-12-06更新
|
532次组卷
|
7卷引用:3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题
名校
4 . 下列事实可以证明NH3·H2O是弱碱的是
| A.氨水能跟CuCl2溶液反应生成Cu(OH)2沉淀 |
| B.铵盐受热易分解,放出氨气 |
| C.0.1mol·L-1的氨水可以使酚酞溶液变红 |
| D.0.1mol·L-1的氨水中,c(OH-)约为0.001mol·L-1 |
您最近一年使用:0次
2023-09-08更新
|
276次组卷
|
6卷引用:鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第1节 水与水溶液 课时1 水的电离 电解质在水溶液中的存在形态
名校
解题方法
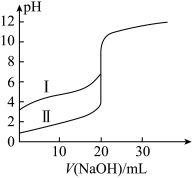
5 . 用 溶液分别滴定20.00ml
溶液分别滴定20.00ml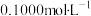 的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
 溶液分别滴定20.00ml
溶液分别滴定20.00ml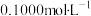 的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
的盐酸和醋酸,滴定曲线如下图所示,下列说法正确的是(V为体积)
| A.I、II分别表示盐酸和醋酸的滴定曲线 |
| B.pH=7时,滴定盐酸消耗的V(NaOH)大于醋酸消耗的V(NaOH) |
C.V(NaOH)=20.00mL时,两溶液中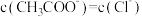 |
D.V(NaOH)=10.00mL时,醋酸溶液中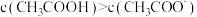 |
您最近一年使用:0次
2022-10-17更新
|
798次组卷
|
5卷引用:实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)北京市北京师范大学附属实验中学2022-2023学年高三上学期月考化学试题河南省鹤壁市高中2022-2023学年高二上学期11月居家测试一化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题11-13)广西壮族自治区苍梧中学2022-2023学年高二下学期3月月考化学试题
22-23高一上·全国·课时练习
解题方法
6 . 强、弱电解质
强电解质与弱电解质比较
强电解质与弱电解质比较
| 强电解质 | 弱电解质 | |
| 定义 | ||
| 溶液中存在微粒种类 | ||
| 举例 | ①强酸: ②强碱: ③绝大部分盐: | ①弱酸: ②弱碱: ③水 |
您最近一年使用:0次
2022高二·全国·专题练习
7 . 已知25℃时,电离平衡常数:
回答下列问题:
(1)下列四种物质电离出质子的能力由大到小的顺序是___________ (填标号)。
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.4×10-7K2=4.7×10-11 | 3.0×10-8 |
(1)下列四种物质电离出质子的能力由大到小的顺序是
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
A. |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.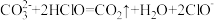 |
D.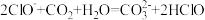 |
A. | B. | C. | D. |
您最近一年使用:0次
8 . 下列事实中,不能说明甲酸(HCOOH)是弱电解质的是
| A.用相同物质的量浓度的盐酸和甲酸溶液做导电性实验,甲酸溶液的灯光较暗 |
| B.甲酸是共价化合物 |
| C.用pH试纸测得0.1 mol·L-1HCOONa溶液的pH>7 |
| D.常温下,新配制的0.1mol·L-1甲酸溶液的pH约为2.37 |
您最近一年使用:0次
2022-10-04更新
|
115次组卷
|
3卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题
9 . 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:
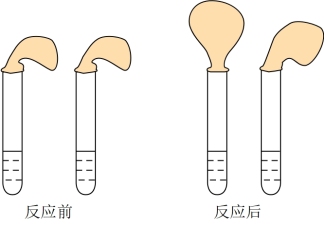
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH____ 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:____ 。
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第____ 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂(选填“A”“B’“C”“D”下同)。
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂。
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为
 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA
您最近一年使用:0次
2022-09-25更新
|
265次组卷
|
2卷引用:微专题(6) 一元强酸与一元弱酸的比较
名校
10 . 25℃时,以0.10 mol∙L−1盐酸滴定0.10 mol∙L−1一元碱YOH的滴定曲线如图所示,下列表述错误的是
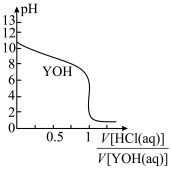

| A.YOH的电离方程式为YOH=Y++OH- | B.此实验可选用甲基橙作指示剂 |
| C.YOH的电离平衡常数Kb≈1×10−5 | D.滴定时盐酸盛放在带活塞的滴定管中 |
您最近一年使用:0次
2022-09-25更新
|
373次组卷
|
3卷引用:实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)河南省豫北名校2022-2023学年高二上学期9月教学质量检测化学试题河南省汝州市第一高级中学2022-2023学年高二上学期11月月考化学试题



