解题方法
1 . 醋酸的电离方程式为CH3COOH(aq) H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: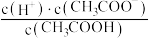 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
 H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: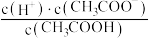 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
| B.向该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01 mol/L的醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
2 . 下列关于弱电解质的电离平衡常数的叙述中,正确的是
| A.弱电解质的电离平衡常数就是电解质溶于水后电离出的各种离子浓度的乘积与未电离分子的浓度的比值 |
| B.弱电解质的电离平衡常数只与弱电解质本身的性质及外界温度有关 |
| C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱 |
| D.多元弱酸的各级电离平衡常数相同 |
您最近一年使用:0次
2023-08-14更新
|
520次组卷
|
3卷引用:第2课时 电离平衡常数
名校
3 . 下列说法错误的是
| A.pH相同的NaOH溶液与Ba(OH)2溶液以任意体积比混合,pH不变 |
| B.浓度均为0.1 mol·L-1的NaOH溶液与Ba(OH)2溶液等体积混合,pH不变 |
| C.常温下,pH=2的溶液与pH=12的溶液等体积混合后,混合溶液的pH不一定等于7 |
| D.常温下,0.05 mol·L-1的硫酸与0.05 mol·L-1的氢氧化钠溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
2023-08-14更新
|
872次组卷
|
4卷引用:第2课时 溶液 pH的计算
名校
4 . 下列事实中一定不能证明CH3COOH是弱电解质的是
①等物质的量浓度、等体积的盐酸、CH3COOH溶液和足量锌反应,根据产生氢气的多少
②用CH3COOH溶液做导电实验,灯泡很暗
③等c(H+)、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的c(H+)=1.0×10-2 mol·L-1
⑤CH3COONa和H3PO4反应,生成CH3COOH
①等物质的量浓度、等体积的盐酸、CH3COOH溶液和足量锌反应,根据产生氢气的多少
②用CH3COOH溶液做导电实验,灯泡很暗
③等c(H+)、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的c(H+)=1.0×10-2 mol·L-1
⑤CH3COONa和H3PO4反应,生成CH3COOH
| A.①② | B.②⑤ | C.①③⑤ | D.③④⑤ |
您最近一年使用:0次
2023-08-14更新
|
1221次组卷
|
5卷引用:微专题(6) 一元强酸与一元弱酸的比较
5 . 常温下,将稀盐酸滴加到等浓度的弱碱AOH溶液中,测得混合液的pH和lg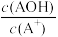 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是

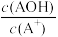 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
| A.常温下,A+的水解平衡常数为1.0×10-10 |
| B.e点溶液中水电离出的H+浓度为10-6.23 mol·L-1 |
| C.c点溶液中:n(A+)+n(AOH)>n(Cl-) |
| D.d点溶液中:c(Cl-)>c(AOH)>c(A+) |
您最近一年使用:0次
真题
6 . 25℃下, 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是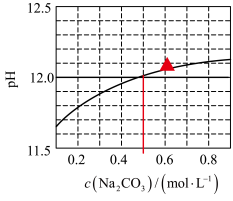
A. 时,溶液中 时,溶液中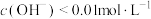 |
B. 水解程度随其浓度增大而减小 水解程度随其浓度增大而减小 |
C.在水中 的 的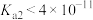 |
D. 的 的 溶液和 溶液和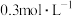 的 的 溶液等体积混合,得到的溶液 溶液等体积混合,得到的溶液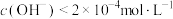 |
您最近一年使用:0次
2023-08-03更新
|
4586次组卷
|
6卷引用:实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)2023年高考海南卷化学真题(已下线)不定项选择题(已下线)第31讲盐类的水解(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)【精品卷】3.3.1 盐类的水解课堂例题-人教版2023-2024学年选择性必修1
名校
解题方法
7 . Ka、Kw、Kh、Ksp分别表示电离常数、水的离子积常数、水解常数、溶度积常数,下列判断不正确的是
A.室温下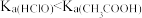 , , 的电离度一定比HClO的大 的电离度一定比HClO的大 |
B.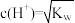 的溶液任何温度下均为中性 的溶液任何温度下均为中性 |
| C.已知25℃时,AgCl和砖红色沉淀Ag2CrO4的Ksp分别为1.8×10-10和2.0×10-12,则用AgNO3标准溶液滴定Cl-时,可采用K2CrO4为指示剂 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大 |
您最近一年使用:0次
2023-12-25更新
|
492次组卷
|
8卷引用:水溶液中的离子反应与平衡——进阶学习
真题
8 . 氯化铁是一种重要的盐,下列说法不正确的是
| A.氯化铁属于弱电解质 | B.氯化铁溶液可腐蚀覆铜板 |
| C.氯化铁可由铁与氯气反应制得 | D.氯化铁溶液可制备氢氧化铁胶体 |
您最近一年使用:0次
2023-06-21更新
|
5385次组卷
|
10卷引用:实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题1-5)(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题05 盐类的水解-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)江西省宜春市百树学校2023-2024学年高三上学期暑期阶段测试化学试卷(已下线)第01讲 物质的分类及转化(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 将 转变为
转变为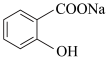 的最佳方法是
的最佳方法是
 转变为
转变为 的最佳方法是
的最佳方法是| A.与稀H2SO4共热后,加入足量的NaOH溶液 |
| B.与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
您最近一年使用:0次
10 . 关于乙酸的说法错误的是
| A.含有羧基 | B.结构简式为CH3COOH | C.能用于除水垢 | D.在水中完全电离 |
您最近一年使用:0次
2023-05-11更新
|
125次组卷
|
3卷引用:3.4.1羧酸(提高)



