1 . 在a、b两支试管中,分别装入形态相同、质量相等的锌粒,然后向两试管中分别加入足量的相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中产生气泡的速率___________ ,原因是______________________ 。
(2)反应完毕后a、b两支试管中生成气体的总体积是V(a)___________ (填“>”“<”或“=”)V(b),原因是___________ 。
(1)a、b两支试管中产生气泡的速率
(2)反应完毕后a、b两支试管中生成气体的总体积是V(a)
您最近一年使用:0次
解题方法
2 . 某固体化合物R不导电,但熔化或溶于水都能完全电离。下列关于物质R的说法中,正确的是
| A.R为非电解质 | B.R是强电解质 |
| C.R是分子晶体 | D.R是弱电解质 |
您最近一年使用:0次
2023-08-27更新
|
184次组卷
|
2卷引用:第1课时 水的电离 电解质在水溶液中的存在形态
解题方法
3 . 下列关于弱电解质的说法正确的是
| A.溶液的导电性弱的化合物 |
| B.分子中存在共价键的化合物 |
| C.溶于水存在溶质分子的化合物 |
| D.溶于水后既存在溶质分子又存在离子的化合物 |
您最近一年使用:0次
4 . 稀氨水中存在着平衡:NH3·H2O
 +OH-,若要使平衡向逆方向移动,同时使c平(OH-)增大,应加入适量的
+OH-,若要使平衡向逆方向移动,同时使c平(OH-)增大,应加入适量的
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤MgSO4固体

 +OH-,若要使平衡向逆方向移动,同时使c平(OH-)增大,应加入适量的
+OH-,若要使平衡向逆方向移动,同时使c平(OH-)增大,应加入适量的①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤MgSO4固体
| A.①②③ | B.③⑤ | C.③ | D.③④ |
您最近一年使用:0次
2023-08-26更新
|
1290次组卷
|
4卷引用:第1课时 弱电解质的电离平衡
解题方法
5 . 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
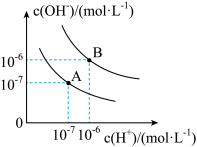
(1)25 ℃时水的电离平衡曲线应为___________ (填“A”或“B”),请说明理由_________________ 。25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间满足的关系是___________ 。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用γ1、γ2表示,则γ1___________ (填“大于”“小于”“等于”或“无法确定”)γ2。

(1)25 ℃时水的电离平衡曲线应为
(2)95 ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间满足的关系是
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用γ1、γ2表示,则γ1
您最近一年使用:0次
解题方法
6 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)当温度升高时,K值_____ (填“增大”“减小”或“不变”)。
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_____ (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
E.加氢氧化钠固体
(3)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2,K2=5.4×10-5,写出草酸的电离方程式_____ 、_____ ,试从电离平衡移动的角度解释K1≫K2的原因_____ 。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实_____ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:_____ 。
| 酸 | CH3COOH | HNO2 | HCN | HClO |
| 电离平衡常数(Ka) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
(2)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
E.加氢氧化钠固体
(3)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2,K2=5.4×10-5,写出草酸的电离方程式
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
7 . 25 ℃时,部分物质的电离平衡常数如下表所示:
(1)NH3·H2O的电离方程式是_____________ ,25 ℃时,物质的量浓度为0.10 mol/L的氨水中,c(OH-)=___________ (列出算式即可)。
(2)25 ℃时,物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系是:CH3COONa________ (填“>”“<”或“=”)NaClO,请结合题目有关信息说明原因__________ 。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式是_____ ,结合所给数据说明生成该产物的理由__________ 。
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O |
电离平 衡常数 | Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 | Kb=1.8×10-5 |
(2)25 ℃时,物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系是:CH3COONa
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式是
您最近一年使用:0次
8 . 回答下列问题
(1)已知常温下CN-的水解常数Kh=1.61×10-5。
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显_______ (填“酸”“碱”或“中”)性,c(CN-)________ (填“>”“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________ 。
②常温下,若将c mol·L-1盐酸与0.62 mol·L-1KCN溶液等体积混合后恰好得到中性溶液,则c=______ (小数点后保留4位数字)。
(2)NO2可用氨水吸收生成NH4NO3。25 ℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是___________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将____________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____________ mol·L-1(NH3·H2O的电离平衡常数取Kb=2×10-5)。
(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则c( )
)________ (填“>”“<”或“=”)2c( ),此时混合溶液中c(NH
),此时混合溶液中c(NH )=176c(NH3·H2O),则NH3·H2O的电离常数Kb为
)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为____________ 。
(4)向10 mL 0.10 mol·L-1的氨水中加入10 mL 0.02 mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀?____________ 。[已知Ca(OH)2的Ksp=5.5×10-6,氨水中c(OH-)≈ ]
]
(1)已知常温下CN-的水解常数Kh=1.61×10-5。
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
②常温下,若将c mol·L-1盐酸与0.62 mol·L-1KCN溶液等体积混合后恰好得到中性溶液,则c=
(2)NO2可用氨水吸收生成NH4NO3。25 ℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是
(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则c(
 )
) ),此时混合溶液中c(NH
),此时混合溶液中c(NH )=176c(NH3·H2O),则NH3·H2O的电离常数Kb为
)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为(4)向10 mL 0.10 mol·L-1的氨水中加入10 mL 0.02 mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀?
 ]
]
您最近一年使用:0次
解题方法
9 . 某温度下,有浓度均为0.1mol•L-1的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液。
已知:
(1)这4种溶液pH由大到小的顺序是_______ (填序号)。
(2)④的水解平衡常数Kh=_______ 。
(3)此温度下,某HCN和NaCN的混合溶液的pH=11,则 为
为_______ 。
已知:
| HCN | H2CO3 | CH3COOH |
| Ka=5.0×10-10 | Ka1=4×10-7 Ka2=5.0×10-11 | Ka=1.7×10-5 |
(2)④的水解平衡常数Kh=
(3)此温度下,某HCN和NaCN的混合溶液的pH=11,则
 为
为
您最近一年使用:0次
10 . 25 ℃时,0.10 mol·L-1HA溶液中有1%的HA电离,则HA的电离平衡常数Ka为___________ 。
您最近一年使用:0次



