名校
解题方法
1 .  、
、 可用于合成化工原料三聚磷酸钠(
可用于合成化工原料三聚磷酸钠( )。
)。
(1)能说明 溶液显弱酸性的离子方程式为
溶液显弱酸性的离子方程式为___________ 。
(2)能说明 溶液显弱碱性的离子方程式为
溶液显弱碱性的离子方程式为____________ 。
(3)测定某三聚磷酸钠试样中 的含量可用间接滴定法,其流程如下:
的含量可用间接滴定法,其流程如下:


①滴定时所用的指示剂X可为_______ 。
② 标准溶液应盛放在如图所示的滴定管
标准溶液应盛放在如图所示的滴定管__________ (填“甲”或“乙”)中。

③滴定实验所得数据记录如下(样品中杂质不与酸或碱反应)。
试计算样品中 的质量分数
的质量分数_________ (列出计算过程,结果保留三位有效数字)。
 、
、 可用于合成化工原料三聚磷酸钠(
可用于合成化工原料三聚磷酸钠( )。
)。(1)能说明
 溶液显弱酸性的离子方程式为
溶液显弱酸性的离子方程式为(2)能说明
 溶液显弱碱性的离子方程式为
溶液显弱碱性的离子方程式为(3)测定某三聚磷酸钠试样中
 的含量可用间接滴定法,其流程如下:
的含量可用间接滴定法,其流程如下:

①滴定时所用的指示剂X可为
②
 标准溶液应盛放在如图所示的滴定管
标准溶液应盛放在如图所示的滴定管
③滴定实验所得数据记录如下(样品中杂质不与酸或碱反应)。
| 滴定次数 | 待测溶液A的体积( ) ) | 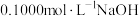 溶液的体积 溶液的体积 | |
滴定前读数( ) ) | 滴定后读数( ) ) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
 的质量分数
的质量分数
您最近一年使用:0次
2020-10-13更新
|
154次组卷
|
2卷引用:人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时1 盐溶液显酸碱性的原因
22-23高二上·全国·课时练习
2 . 有关电离平衡的理解不正确的是
| A.电解质在溶液中达到电离平衡时,分子浓度和离子的浓度相等 |
| B.电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变 |
| C.电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行 |
| D.改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡 |
您最近一年使用:0次
3 . 水体中的含氮化合物是引起富营养化的主要污染物,分析监测水体中的硝酸(盐)和亚硝酸(盐)含量,控制水体中的含氮污染物,对水资源的循环利用意义重大。
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为_________ 。
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为________ 。
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为________ ,其中氧化产物为________ (写化学式)。
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为
您最近一年使用:0次
4 . 水体中的含氮化合物是引起富营养化的主要污染物,分析监测水体中的硝酸(盐)和亚硝酸(盐)含量,控制水体中的含氮污染物,对水资源的循环利用意义重大。
(1)亚硝酸( )是一种弱酸,其电离平衡常数的表达式为
)是一种弱酸,其电离平衡常数的表达式为_____________________________ 。
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、 、
、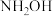 、
、 等。
等。
①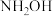 中,氮元素的化合价为
中,氮元素的化合价为__________________________ 。
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为_______________________________________ ,其中氧化产物为________________ (写化学式)。
③取20mL含 的水样,酸化后用0.001mol/L的KI标准溶液滴定(反应中含N的生成物为NO),滴定前和滴定后的滴定管内液面高度如图所示,由此可知水样中
的水样,酸化后用0.001mol/L的KI标准溶液滴定(反应中含N的生成物为NO),滴定前和滴定后的滴定管内液面高度如图所示,由此可知水样中 的浓度为
的浓度为_________ mg/L。

(1)亚硝酸(
 )是一种弱酸,其电离平衡常数的表达式为
)是一种弱酸,其电离平衡常数的表达式为(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、
 、
、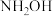 、
、 等。
等。①
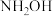 中,氮元素的化合价为
中,氮元素的化合价为②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为
③取20mL含
 的水样,酸化后用0.001mol/L的KI标准溶液滴定(反应中含N的生成物为NO),滴定前和滴定后的滴定管内液面高度如图所示,由此可知水样中
的水样,酸化后用0.001mol/L的KI标准溶液滴定(反应中含N的生成物为NO),滴定前和滴定后的滴定管内液面高度如图所示,由此可知水样中 的浓度为
的浓度为
您最近一年使用:0次
5 . 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,可采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题:
表1 几种盐的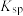
表2 工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度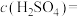
__________  。
。
(2)若酸性废水中 的浓度为
的浓度为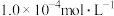 ,则
,则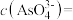
__________  。
。
(3)工厂排放出的酸性废水中的三价砷(弱酸 )不易沉降,可投入
)不易沉降,可投入 先将其氧化成五价砷(弱酸
先将其氧化成五价砷(弱酸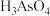 ),此时
),此时 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以 的形式沉降。
的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ 。
② 在pH调节到8左右才开始沉淀,原因为
在pH调节到8左右才开始沉淀,原因为______________ 。
③砷酸( )分步电离的平衡常数(25℃)为
)分步电离的平衡常数(25℃)为 ,
,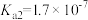
 ,
,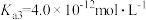 ,第三步电离的平衡常数表达式为
,第三步电离的平衡常数表达式为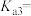
_________ , 第一步水解的离子方程式为
第一步水解的离子方程式为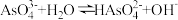 ,该步水解的平衡常数(25℃)为
,该步水解的平衡常数(25℃)为__________ 。
表1 几种盐的
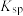
| 难溶物 | 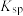 |
 | 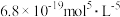 |
 |  |
 | 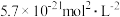 |
表2 工厂污染物排放浓度及允许排放标准
| 污染物 |  | As |
| 废水浓度 | 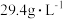 | 1.6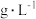 |
| 排放标准 | 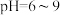 | 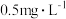 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度
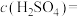
 。
。(2)若酸性废水中
 的浓度为
的浓度为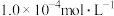 ,则
,则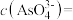
 。
。(3)工厂排放出的酸性废水中的三价砷(弱酸
 )不易沉降,可投入
)不易沉降,可投入 先将其氧化成五价砷(弱酸
先将其氧化成五价砷(弱酸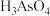 ),此时
),此时 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以
 的形式沉降。
的形式沉降。①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②
 在pH调节到8左右才开始沉淀,原因为
在pH调节到8左右才开始沉淀,原因为③砷酸(
 )分步电离的平衡常数(25℃)为
)分步电离的平衡常数(25℃)为 ,
,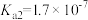
 ,
,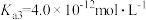 ,第三步电离的平衡常数表达式为
,第三步电离的平衡常数表达式为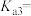
 第一步水解的离子方程式为
第一步水解的离子方程式为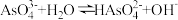 ,该步水解的平衡常数(25℃)为
,该步水解的平衡常数(25℃)为
您最近一年使用:0次
名校
6 . 食醋分为酿造醋和配制醋两种。国家规定食醋中总酸量不得低于3.5g/(100mL)。
(1)某研究小组利用滴定分析法测定某品牌食醋中 的含量,下列说法正确的是
的含量,下列说法正确的是__________ (填序号)。
A.用NaOH溶液滴定时反应的离子方程式为
B.食醋试样需稀释一定倍数后再进行滴定
C.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
D.若测得该品牌食醋中 的物质的量浓度为
的物质的量浓度为 ,则该食醋的总酸量为4.5g/(100mL)
,则该食醋的总酸量为4.5g/(100mL)
(2)常温下,用 的NaOH溶液分别滴定20.00mL
的NaOH溶液分别滴定20.00mL 的HCl溶液和20.00mL
的HCl溶液和20.00mL 的
的 溶液,得到两条滴定曲线,如图所示。
溶液,得到两条滴定曲线,如图所示。

①滴定 溶液的曲线是
溶液的曲线是________ (填“图1”或“图2”);滴定曲线中
_________ 。
②E点溶液呈__________ 性,该溶液中的溶质是_____________________________ 。
(1)某研究小组利用滴定分析法测定某品牌食醋中
 的含量,下列说法正确的是
的含量,下列说法正确的是A.用NaOH溶液滴定时反应的离子方程式为

B.食醋试样需稀释一定倍数后再进行滴定
C.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
D.若测得该品牌食醋中
 的物质的量浓度为
的物质的量浓度为 ,则该食醋的总酸量为4.5g/(100mL)
,则该食醋的总酸量为4.5g/(100mL)(2)常温下,用
 的NaOH溶液分别滴定20.00mL
的NaOH溶液分别滴定20.00mL 的HCl溶液和20.00mL
的HCl溶液和20.00mL 的
的 溶液,得到两条滴定曲线,如图所示。
溶液,得到两条滴定曲线,如图所示。
①滴定
 溶液的曲线是
溶液的曲线是
②E点溶液呈
您最近一年使用:0次
2020-10-11更新
|
214次组卷
|
2卷引用:鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第4节 离子反应 课时2 离子反应的应用——酸碱中和滴定
名校
7 . 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是


| A.亚氯酸钠在碱性条件下较稳定 |
| B.25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| C.25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
| D.若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-) |
您最近一年使用:0次
2018-05-01更新
|
544次组卷
|
5卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节综合训练



