名校
解题方法
1 . 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
甲同学认为该溶液pH升高的原因是 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
(1)乙同学认为该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度___________ (填“大于”或“小于”)NaHCO3的水解程度。
(2)丙同学认为甲、乙的判断都不充分,还需要进一步做实验来验证。
①在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学的判断正确。其中试剂X是____________ (填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10℃,若溶液的pH___________ (填“高于”“低于”或“等于”)8.3,则甲同学的判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙同学断言___________ (填“甲”或“乙”)同学的判断是错误的,理由是___________ 。
(3)下列关于NaHCO3饱和水溶液的表述正确的是___________(填序号)。
| 温度 | 10℃ | 20℃ | 30℃ | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。(1)乙同学认为该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(2)丙同学认为甲、乙的判断都不充分,还需要进一步做实验来验证。
①在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学的判断正确。其中试剂X是
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10℃,若溶液的pH
③查阅资料,发现NaHCO3的分解温度为150℃,丙同学断言
(3)下列关于NaHCO3饱和水溶液的表述正确的是___________(填序号)。
A. |
B.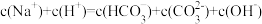 |
C. 的电离程度大于 的电离程度大于 的水解程度 的水解程度 |
您最近一年使用:0次
2021-08-07更新
|
534次组卷
|
10卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用
鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)3.3.1+盐溶液呈现不同酸碱性的原因-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)3.3.2影响盐类水解的因素 课后贵州省铜仁第一中学2020届高三上学期第二次月考化学试题(已下线)第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题
22-23高二·全国·课时练习
2 . 电离平衡常数意义
电离平衡常数表示弱电解质的电离能力。一定温度下,K值_______ ,弱电解质的电离程度_______ ,酸性(或碱性)_______ 。
电离平衡常数表示弱电解质的电离能力。一定温度下,K值
您最近一年使用:0次
3 . 下列关于弱电解质的电离平衡常数的叙述中,正确的是
| A.弱电解质的电离平衡常数就是电解质溶于水后电离出的各种离子浓度的乘积与未电离分子的浓度的比值 |
| B.弱电解质的电离平衡常数只与弱电解质本身的性质及外界温度有关 |
| C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱 |
| D.多元弱酸的各级电离平衡常数相同 |
您最近一年使用:0次
2023-08-14更新
|
515次组卷
|
3卷引用:第2课时 电离平衡常数
20-21高二下·河南濮阳·期末
名校
4 . 根据实验操作和现象,不能得出相应结论的是
| 实验操作和现象 | 结论 | |
| A | 在常温下,等体积、pH=12的两种碱溶液MOH和ROH分别加水稀释10倍,稀释后,MOH溶液的pH大 | 碱性: |
| B | 常温下,分别测NaA溶液与NaB溶液的pH,NaA溶液的pH大 | 酸性: |
| C | 某溶液中滴加 溶液、产生蓝色沉淀 溶液、产生蓝色沉淀 | 原溶液中有 |
| D | 向2mL  溶液中滴加3mL等浓度的NaCl溶液后,再滴加KI溶液,先产生白色沉淀,后出现黄色沉淀。 溶液中滴加3mL等浓度的NaCl溶液后,再滴加KI溶液,先产生白色沉淀,后出现黄色沉淀。 | 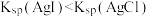 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
11-12高二上·江西吉安·期中
名校
解题方法
5 . 下列叙述正确的是
| A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14 |
| B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱 |
您最近一年使用:0次
2022-04-11更新
|
232次组卷
|
18卷引用:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷
(已下线)2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(已下线)2011-2012年江西省吉安一中高二上学期期中考试化学(理)试题(已下线)2014届高考化学二轮复习提分训练 专题7水溶液中的离子平衡练习卷(已下线)2014-2015学年山西省山大附中高二上学期期中化学试卷2015-2016学年辽宁省实验中学高一下学期期末考试化学卷2016-2017学年陕西省西安一中高二上期中化学试卷甘肃省临夏中学2016-2017学年高二上学期期末考试化学试题西藏自治区拉萨中学2017-2018学年高二上学期第二次月考理综化学试题安徽省定远重点中学2018-2019学年高二上学期第三次月考化学试题云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题江苏省启东中学2019-2020学年高二上学期第一次质量检测化学试题陕西省西安中学2019-2020学年高二12月月考化学试题陕西省黄陵中学2019-2020学年高二上学期期末考试(重点班)化学试题(已下线)3.2.1 溶液的酸碱性(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)云南省玉溪市通海县第一中学2021-2022学年高二上学期期末考试化学试题云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题(已下线)3.1.1 水的电离和溶液的酸碱性-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)贵州省威宁彝族回族苗族自治县第八中学2023-2024学年高二上学期期中考试化学试卷
20-21高二上·吉林延边·阶段练习
名校
解题方法
6 . 某酸H2A在水中的电离方程式是:H2A=H++HA-,HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显___________ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因___________ 。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是___________。
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________ (填“>”、“<”或“=”)0.11 mol·L-1;理由是___________ 。
 H++A2-回答下列问题:
H++A2-回答下列问题:(1)Na2A溶液显
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是___________。
| A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1 | B.c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
您最近一年使用:0次
2021-08-24更新
|
430次组卷
|
4卷引用:3.3.1 盐溶液的酸碱性及其原因(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.3.1 盐溶液的酸碱性及其原因(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题上海行知中学2021-2022学年高二上学期期中考试化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题
20-21高二下·广西桂林·期末
名校
解题方法
7 . 常温下,将 的盐酸与
的盐酸与 的氨水等体积混合,关于该溶液酸碱性的描述正确的是
的氨水等体积混合,关于该溶液酸碱性的描述正确的是
 的盐酸与
的盐酸与 的氨水等体积混合,关于该溶液酸碱性的描述正确的是
的氨水等体积混合,关于该溶液酸碱性的描述正确的是| A.可能显中性 | B.一定显碱性 | C.不可能显碱性 | D.可能显酸性 |
您最近一年使用:0次
2021-07-15更新
|
348次组卷
|
4卷引用:3.2.2 溶液的pH(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.2.2 溶液的pH(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广西桂林市2020-2021学年高二下学期期末质量检测化学试题吉林省长岭县第二中学2021-2022学年高二上学期第一次考试化学试题北京市第二十二中学2022-2023学年高二上学期期中考试化学试题
解题方法
8 . 回答下列问题
(1) 时,水的
时,水的 ,则该温度
,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)在(1)中所述温度下, 的溶液呈
的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的
___________  。
。
(3)实验室用Zn和稀硫酸制取 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,pH=4的盐酸中水的电离程度___________ (填“大于”“小于”或“等于”)pH=10的 溶液中水的电离程度。
溶液中水的电离程度。
(5) 乙酸(甲,
乙酸(甲,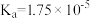 )和
)和 氯乙酸(乙,
氯乙酸(乙,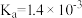 )的水溶液,下列可以表示两溶液中由水电离出的
)的水溶液,下列可以表示两溶液中由水电离出的 与加入水的体积
与加入水的体积 之间关系的是
之间关系的是___________ (填字母)。
a. b.
b.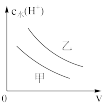 c.
c. d.
d.
(1)
 时,水的
时,水的 ,则该温度
,则该温度(2)在(1)中所述温度下,
 的溶液呈
的溶液呈
 。
。(3)实验室用Zn和稀硫酸制取
 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡(4)25℃时,pH=4的盐酸中水的电离程度
 溶液中水的电离程度。
溶液中水的电离程度。(5)
 乙酸(甲,
乙酸(甲,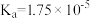 )和
)和 氯乙酸(乙,
氯乙酸(乙,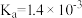 )的水溶液,下列可以表示两溶液中由水电离出的
)的水溶液,下列可以表示两溶液中由水电离出的 与加入水的体积
与加入水的体积 之间关系的是
之间关系的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2021-12-06更新
|
612次组卷
|
6卷引用:选择性必修1(SJ)专题3第一单元课时3 水的电离
选择性必修1(SJ)专题3第一单元课时3 水的电离(已下线)3.1.3 水的电离平衡-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.2.1 水的电离 溶液的酸碱性(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)3.1.2水的电离平衡 课后(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第二次月考化学试题
20-21高二下·广西贵港·阶段练习
9 . (1)某温度(t℃)时,水的Kw=1×10-12,则该温度___________ (填“>”“<”或“=”)25℃,其理由是___________ 。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___________ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=___________ mol·L-1。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________ 移动。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是___________ (填序号)。
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度___________ pH=10的Ba(OH)2溶液中水的电离程度。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl②H2SO4③CH3COOH(Ka=1.7×10-5)④NH3·H2O(Kb=1.7×10-5)⑤NaOH⑥Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
2021-04-16更新
|
1595次组卷
|
5卷引用:3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省滨州市沾化区实验高级中学2022-2023学年高二10月月考化学试题
20-21高二上·重庆云阳·阶段练习
名校
解题方法
10 . 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
(1)根据上表可知,酸性
_____  ,在相同条件下,试比较Na2CO3、Na2SO3溶液的pH:Na2CO3
,在相同条件下,试比较Na2CO3、Na2SO3溶液的pH:Na2CO3_____ Na2SO3。(填“>” “<”或 “=”,下同)
(2)向0.1 mol∙L−1的CH3COONa溶液中加入少量下列物质,其水解程度增大的是______ 。
A NaCl溶液 B Na2CO3固体 C NH4Cl溶液 D CH3COONa固体
(3)已知常温下NH3∙H2O的电离常数 ,则常温下CH3COONH4溶液的pH
,则常温下CH3COONH4溶液的pH_______ 7。
(4)将pH=4的 溶液稀释100倍后溶液的pH范围是
溶液稀释100倍后溶液的pH范围是_______ ,图中的纵坐标可以是______ 。

a.溶液的pH
b.醋酸的电离平衡常数
c.溶液的导电能力
d.醋酸的电离程度
(5)NaHSO3是中学化学常见的物质。 在水溶液中存在如下两个平衡:
在水溶液中存在如下两个平衡:
 Ka2
Ka2
 Kh2 (水解平衡常数,表示水解程度)
Kh2 (水解平衡常数,表示水解程度)
已知25 ℃时,Ka2 > Kh2,则0.1 mol∙L−1 NaHSO3溶液:
①溶液呈__________ (填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______ c( )(填“>”“<”或“=”);
)(填“>”“<”或“=”);
③写出该溶液中的守恒式:
电荷守恒:_____________ ,物料守恒:________________ ,质子守恒:_______________ 。
| 酸 | 电离平衡常数 |
| 醋酸 | 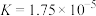 |
| 碳酸 | 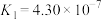 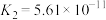 |
| 亚硫酸 |   |
(1)根据上表可知,酸性

 ,在相同条件下,试比较Na2CO3、Na2SO3溶液的pH:Na2CO3
,在相同条件下,试比较Na2CO3、Na2SO3溶液的pH:Na2CO3(2)向0.1 mol∙L−1的CH3COONa溶液中加入少量下列物质,其水解程度增大的是
A NaCl溶液 B Na2CO3固体 C NH4Cl溶液 D CH3COONa固体
(3)已知常温下NH3∙H2O的电离常数
 ,则常温下CH3COONH4溶液的pH
,则常温下CH3COONH4溶液的pH(4)将pH=4的
 溶液稀释100倍后溶液的pH范围是
溶液稀释100倍后溶液的pH范围是
a.溶液的pH
b.醋酸的电离平衡常数
c.溶液的导电能力
d.醋酸的电离程度
(5)NaHSO3是中学化学常见的物质。
 在水溶液中存在如下两个平衡:
在水溶液中存在如下两个平衡: Ka2
Ka2 Kh2 (水解平衡常数,表示水解程度)
Kh2 (水解平衡常数,表示水解程度)已知25 ℃时,Ka2 > Kh2,则0.1 mol∙L−1 NaHSO3溶液:
①溶液呈
②溶液中c(Na+)
 )(填“>”“<”或“=”);
)(填“>”“<”或“=”);③写出该溶液中的守恒式:
电荷守恒:
您最近一年使用:0次



