名校
1 . 部分弱酸的电离常数如表所示:
下列选项错误的是
弱酸 | HCOOH | HCN |
|
电离常数( | 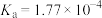 | 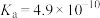 | 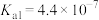  |
下列选项错误的是
A.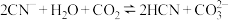 |
B.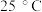 时, 时, 的HCOOH溶液与 的HCOOH溶液与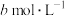 的NaOH溶液等体积混合后溶液呈中性,则 的NaOH溶液等体积混合后溶液呈中性,则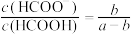 |
C.中和等体积、等 的HCOOH溶液和HCN溶液消耗NaOH的量前者小于后者 的HCOOH溶液和HCN溶液消耗NaOH的量前者小于后者 |
| D.HCN溶液加水稀释后,溶液中所有离子的数目均减少 |
您最近一年使用:0次
2020-10-05更新
|
289次组卷
|
2卷引用:人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 方法帮
解题方法
2 . 下列说法正确的是
A.NaHCO3在水溶液中的电离方程式为NaHCO3=Na++H++CO |
| B.在水中完全电离的可溶性盐是强电解质,在水中溶解度很小的难溶性盐是弱电解质 |
| C.强电解质水溶液的导电性不一定强于弱电解质水溶液的导电性 |
| D.强电解质在水溶液中或熔融状态下完全电离,以离子形式存在 |
您最近一年使用:0次
解题方法
3 . 室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
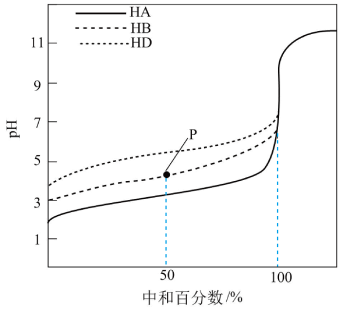

| A.三种酸的电离常数关系:KHA<KHB<KHD |
| B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) |
| C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) |
| D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
您最近一年使用:0次
14-15高二上·黑龙江·期中
4 . 部分弱酸的电离平衡常数如表所示:
下列说法错误的是( )
| 弱酸 |  |  |  |
电离常数/( )(25℃) )(25℃) | 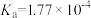 | 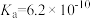 | 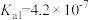 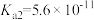 |
A.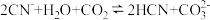 |
B. |
C.中和等体积、等pH的 和 和 溶液,前者消耗 溶液,前者消耗 的量小于后者 的量小于后者 |
D.等体积、等浓度的 和 和 溶液中,前者所含离子总数小于后者 溶液中,前者所含离子总数小于后者 |
您最近一年使用:0次
2020-09-17更新
|
133次组卷
|
8卷引用:鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解
5 . 室温下,现有四种溶液:① 的氨水;②
的氨水;② 的
的 溶液;③
溶液;③ 的
的 溶液;④
溶液;④ 的
的 溶液。已知
溶液。已知 ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )
 的氨水;②
的氨水;② 的
的 溶液;③
溶液;③ 的
的 溶液;④
溶液;④ 的
的 溶液。已知
溶液。已知 ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )A.向①②中分别加入适量的 晶体后,溶液的pH均减小 晶体后,溶液的pH均减小 |
| B.分别加水稀释至原来体积的10倍,四种溶液的pH大小关系为②>①>③>④ |
| C.四种溶液中溶质的物质的量浓度大小关系为①=③>④>② |
| D.四种溶液中水的电离程度的大小关系为①=②=③=④ |
您最近一年使用:0次
6 . 下列可以使 稀溶液中
稀溶液中 的电离程度增大的是( )
的电离程度增大的是( )
 稀溶液中
稀溶液中 的电离程度增大的是( )
的电离程度增大的是( )| A.滴加少量浓盐酸 | B.加热溶液 |
| C.加水稀释 | D.加入少量 晶体 晶体 |
您最近一年使用:0次
名校
解题方法
7 . 室温下,甲、乙两烧杯均盛有5mLpH=3的醋酸溶液,向乙烧杯加水稀释至溶液pH=4,关于两烧杯中所得溶液的描述正确的是( )
| A.溶液体积:10V甲<V乙 |
| B.水电离出的OH-浓度:10c(OH-)甲 < c(OH-)乙 |
| C.若分别用等物质的量浓度的NaOH溶液完全中和,所得溶液的pH:甲<乙 |
| D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲<乙 |
您最近一年使用:0次
2020-04-03更新
|
316次组卷
|
6卷引用:3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)
(已下线)3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题上海市2018年高中化学竞赛初赛试题(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
名校
8 . 室温下,0.1mol·L-1的某二元酸H2A溶液中,逐渐加入NaOH溶液,可能存在的含A粒子的物质的量分数随pH变化的关系如图所示,下列说法正确的是


| A.H2A的电离方程式:H2A⇌H++HA- |
| B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 |
| C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-) |
| D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
您最近一年使用:0次
2020-03-12更新
|
255次组卷
|
3卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节综合训练
名校
9 . 某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
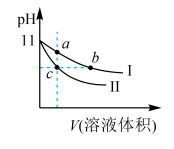

| A.Ⅰ为氨水稀释时的pH值变化曲线 |
| B.a、b、c三点溶液的导电性:c>b=a |
| C.a、b、c三点溶液中水的电离程度:c=b>a |
| D.用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc |
您最近一年使用:0次
2020-02-29更新
|
158次组卷
|
3卷引用:3.2.2 pH的计算及应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)
(已下线)3.2.2 pH的计算及应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)江苏省南通市如皋市白蒲高级中学2019-2020学年高二下学期第一周测试化学试题重庆市2021届高三上学期第一次预测性考试化学试题
名校
解题方法
10 . 下列说法正确的是( )。
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱溶液可使溶液中 CH3COO-+H+,加少量烧碱溶液可使溶液中 值增大 值增大 |
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
| C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- ) |
您最近一年使用:0次
2019-11-28更新
|
133次组卷
|
3卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节综合训练




