1 . 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO的说法正确的是
| A.酸的强弱:HCN<HClO |
| B.pH:HClO>HCN |
| C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D.酸根离子浓度:c平(CN-)<c平(ClO-) |
您最近一年使用:0次
2 . 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.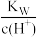 >1.0×10-7 mol·L-1 >1.0×10-7 mol·L-1 |
B.c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
C.c(H+)+c( )=c(OH-)+c( )=c(OH-)+c( )+2c( )+2c( ) ) |
D.c(Cl-)>c( )>c( )>c( )>c( )>c( ) ) |
您最近一年使用:0次
2023·海南·高考真题
真题
3 . 25℃下, 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
 水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是
水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是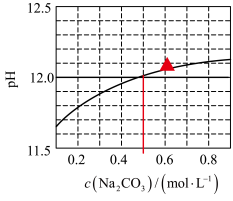
A.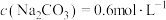 时,溶液中 时,溶液中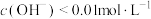 |
B. 水解程度随其浓度增大而减小 水解程度随其浓度增大而减小 |
C.在水中 的 的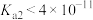 |
D. 的 的 溶液和 溶液和 的 的 溶液等体积混合,得到的溶液 溶液等体积混合,得到的溶液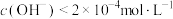 |
您最近一年使用:0次
2023-08-03更新
|
4403次组卷
|
6卷引用:实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)2023年高考海南卷化学真题(已下线)不定项选择题(已下线)第31讲盐类的水解(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)课时1盐类的水解课堂例题
4 . 亚砷酸(H3AsO3)是一种三元弱酸,可以用于治疗白血病。亚砷酸溶液中存在多种微粒,其中含砷微粒的物质的量分数随pH变化曲线如图所示,下列说法正确的是
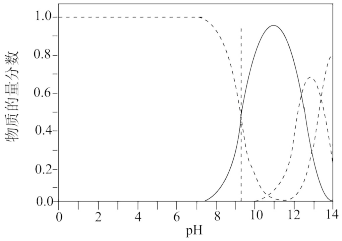

| A.人体血液的pH在7.35~7.45之间,用药后人体中含砷元素的微粒以H3AsO3为主 |
| B.该实验温度下,亚砷酸的电离平衡常数Ka1的数量级为10-10 |
C.pH=12时,溶液中c(H2AsO )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO )+c(OH-)=c(H+) )+c(OH-)=c(H+) |
| D.由图象可知,亚砷酸的电离平衡常数Ka1、Ka2与水的离子积Kw之间满足关系式:Kw<Ka1·Ka2 |
您最近一年使用:0次
2022-02-20更新
|
277次组卷
|
3卷引用:章末检测卷(三)物质在水溶液中的行为
名校
5 . H2S水溶液中存在电离平衡H2S H++HS﹣和HS﹣
H++HS﹣和HS﹣ H++S2﹣。若向H2S溶液中
H++S2﹣。若向H2S溶液中
 H++HS﹣和HS﹣
H++HS﹣和HS﹣ H++S2﹣。若向H2S溶液中
H++S2﹣。若向H2S溶液中| A.加水,平衡向右移动,溶液中氢离子浓度减小 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
您最近一年使用:0次
2021-10-22更新
|
462次组卷
|
5卷引用:作业(十八) 弱电解质的电离平衡
21-22高二上·湖南长沙·阶段练习
6 . 已知25℃时有关弱酸的电离平衡常数如下表所示,则下列有关说法正确的是
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10−5 | 4.9×10−10 | K1=4.3×10−7 K2=5.6×10−11 |
| A.等物质的量浓度的各溶液pH关系为:pH(CH3COOH)<pH(H2CO3)<pH(HCN) |
| B.醋酸溶液加水稀释,其电离程度先增大后减小 |
| C.NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3 |
D.H2CO3的电离常数表达式: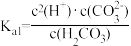 |
您最近一年使用:0次
2021-10-12更新
|
694次组卷
|
4卷引用:水溶液中的离子反应与平衡——课时2电离平衡常数
(已下线)水溶液中的离子反应与平衡——课时2电离平衡常数湖南省长沙市周南中学2021-2022学年高二上学期第一次月考化学试题湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题(已下线)第15讲 电离平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
20-21高二上·河北石家庄·阶段练习
名校
7 . 常温下,浓度均为0.1mol·L-1的三种溶液:①醋酸溶液②醋酸钠溶液③碳酸钠溶液。已知醋酸的电离平衡常数为K=1.8×10-5。下列说法正确的是
| A.溶液中c(CH3COO-):①>② |
| B.溶液的pH:②<③<① |
| C.水的电离程度:①<②<③ |
| D.①与②等体积混合溶液中:c(CH3COO-)>c(CH3COOH) |
您最近一年使用:0次
20-21高二上·河北石家庄·阶段练习
名校
解题方法
8 . 常温下,Ka(HCOOH)=1.8×10-4,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5,下列说法正确的是
| A.浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 |
| C.0.2mol·L-1HCOOH与0.1mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(H+)+c(HCOOH) |
| D.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
您最近一年使用:0次
20-21高三·山东·开学考试
9 . 室温下,用0.1mol·L-1的盐酸分别滴定20mL0.1mol·L-1两种y元弱碱,AG与所加盐酸的体积(V)关系如图所示。已知:AG=lg 。
。
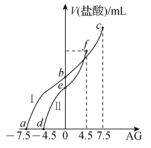
下列说法错误的是
 。
。
下列说法错误的是
| A.曲线I对应碱的碱性强于等浓度曲线II对应碱的碱性 |
| B.溶液中弱碱阳离子的浓度b点和e点相同 |
| C.由e点到f点的过程中水的电离程度逐渐减小 |
| D.Kb(II)约为10-8.5mol·L-1 |
您最近一年使用:0次
2012高二·广东·竞赛
解题方法
10 . 体积分别为VaL和VbL的等物质的量浓度的某一元弱酸HA和某一元强碱BOH,下列说法正确的是
| A.常温下,一元弱酸溶液中水电离的c(H+)小于一元强碱溶液中 |
| B.按Va∶Vb=2∶1混合后,溶液中存在如:c(H+)+c(B+)=c(OH-)+c(A-) |
| C.HA与BOH反应至溶液恰好呈中性时,Va=Vb |
| D.将等物质的量浓度的HA和BA等体积混合,溶液中:2c(B+)=c(HA)+c(A-) |
您最近一年使用:0次



