1 . 水溶液中的离子平衡在生产生活中有广泛的应用,下列说法正确的是
| A.蒸干氯化镁溶液并灼烧可得到干燥的氯化镁固体 |
| B.用氯化铵溶液除去铁器表面的铁锈是利用了电离生成的氢离子 |
C.向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察到溶液颜色变浅,证明 溶液,观察到溶液颜色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
D. 的盐酸和 的盐酸和 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 的碳酸钠溶液中,二者由水电离出的氢离子浓度一定相同 |
您最近一年使用:0次
名校
2 . 常温时,分别向10mL浓度均为1mol/L的HCOOH和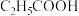 两种酸溶液加水稀释,所得pH与
两种酸溶液加水稀释,所得pH与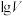 (V为溶液的体积)的关系如图所示。下列说法正确的是
(V为溶液的体积)的关系如图所示。下列说法正确的是
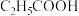 两种酸溶液加水稀释,所得pH与
两种酸溶液加水稀释,所得pH与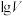 (V为溶液的体积)的关系如图所示。下列说法正确的是
(V为溶液的体积)的关系如图所示。下列说法正确的是
A.1mol/L溶液中水的电离程度: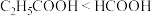 |
B.当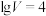 时,HCOOH的 时,HCOOH的 |
C.加入0.4g NaOH后,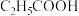 溶液中存在 溶液中存在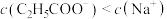 |
D.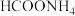 中 中 浓度小于 浓度小于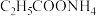 中 中 浓度 浓度 |
您最近一年使用:0次
2023-07-07更新
|
125次组卷
|
3卷引用:云南省大理白族自治州2022-2023学年高二下学期7月期末化学试题
3 . R、X、Y、Z四种短周期主族元素,其原子半径与原子序数关系如图所示。已知:它们的原子序数之和等于51,R的原子序数与Z的最子外层电子数均为7。下列叙述错误的是
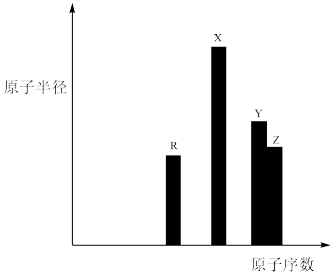
| A.最简单氢化物的稳定性:Y< Z |
| B.同浓度的最简单氢化物水溶液的pH:R> Z> Y |
| C.化合物X2Y2中含两种化学键 |
| D.等浓度的X、Z最高价氧化物对应的水化物的稀溶液中,水的电离程度相同 |
您最近一年使用:0次
2023-06-03更新
|
129次组卷
|
3卷引用:广西壮族自治区玉林市2023届高三下学期学业水平考试理综化学试题
名校
解题方法
4 . 在某温度时,将n mol/L氨水滴入10 mL 1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
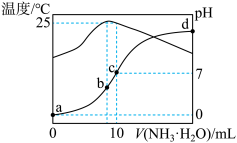
A.a点 |
| B.b点水的电离程度最大,c点水的电离程度最小 |
C.d点: |
D.25℃时, 水解平衡常数为 水解平衡常数为 |
您最近一年使用:0次
2023-04-16更新
|
221次组卷
|
2卷引用:湖北省荆州市沙市区湖北省沙市中学等5校2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 常温下,用如图1所示装置,向10mL 0.1 mol·L-1 Na2CO3和c mol·L-1NaHCO3混合溶液中逐滴滴加0.1 mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示(忽略温度的变化)。下列说法错误的是
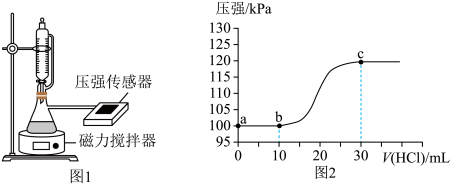
| A.c=0.1 |
B.a点的溶液中: 2c(Na+)=3[c( )+c( )+c( )+c(H2CO3)] )+c(H2CO3)] |
C.b点的溶液中:c( )>c( )>c( )>c(H2CO3) )>c(H2CO3) |
| D.a、b两点水的电离程度: a>b |
您最近一年使用:0次
2023-04-14更新
|
456次组卷
|
4卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题(已下线)2023年湖南卷高考真题变式题(选择题11-14)广西玉林市博白县2023-2024学年高三上学期六校联考化学试卷 海南省海南中学2023-2024学年高三下学期第6次月考化学试题
解题方法
6 . 向 溶液中持续滴加稀盐酸,记录溶液
溶液中持续滴加稀盐酸,记录溶液 及温度随时间的变化如图所示。下列说法正确的是
及温度随时间的变化如图所示。下列说法正确的是
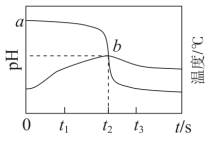
 溶液中持续滴加稀盐酸,记录溶液
溶液中持续滴加稀盐酸,记录溶液 及温度随时间的变化如图所示。下列说法正确的是
及温度随时间的变化如图所示。下列说法正确的是
A. 溶液的起始浓度为 溶液的起始浓度为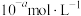 |
| B.在滴定至终点的过程中,水的电离程度不断减小 |
C. 对应的溶液中均存在: 对应的溶液中均存在: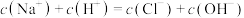 |
D.由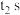 后溶液的温度变化可推知, 后溶液的温度变化可推知, 与 与 的反应是吸热反应 的反应是吸热反应 |
您最近一年使用:0次
2023-01-06更新
|
459次组卷
|
2卷引用:北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷
7 . 按要求填空。
(1)已知室温时, 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中
_______  。
。
②HA的电离平衡常数K=_______ 。
③由HA电离出的 约为水电离出的
约为水电离出的 的
的_______ 倍。
(2)部分弱酸的电离平衡常数如下表:
按要求回答下列问题:
①HCOOH、 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为_______ 。
②同浓度的 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
③运用上述电离常数及物质的特性写出下列反应的离子方程式
i. 溶液中通入过量
溶液中通入过量
_______ 。
ii.过量 通入NaClO溶液中
通入NaClO溶液中_______ 。
(3)已知 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: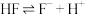 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是_______ (填标号)。
①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
(1)已知室温时,
 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:①该溶液中

 。
。②HA的电离平衡常数K=
③由HA电离出的
 约为水电离出的
约为水电离出的 的
的(2)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH |  |  | HClO |
| 电离平衡常数(25℃) | 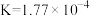 | 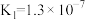 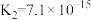 | 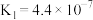 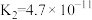 | 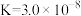 |
①HCOOH、
 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为②同浓度的
 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为③运用上述电离常数及物质的特性写出下列反应的离子方程式
i.
 溶液中通入过量
溶液中通入过量
ii.过量
 通入NaClO溶液中
通入NaClO溶液中(3)已知
 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: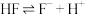 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
您最近一年使用:0次
2022-11-16更新
|
281次组卷
|
2卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
名校
解题方法
9 . 常温下,浓度相同的一元弱酸 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是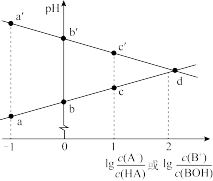
A.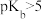 | B.a和a′点的纵坐标之和为14 |
C.水的电离程度: | D.溶液中的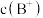 :c点大于c′点 :c点大于c′点 |
您最近一年使用:0次
2022-05-05更新
|
648次组卷
|
4卷引用:山东省济南市2022届高三第二次模拟化学试题
解题方法
10 . 人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
 ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)| A.正常人血液内Kw=10-14 |
B.当过量的碱进入血液中时,只发生反应HCO +OH-=CO +OH-=CO +H2O +H2O |
C.正常人血液中存在:c(HCO )+c(OH-)+2c(CO )+c(OH-)+2c(CO )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.由题给数据可算得正常人血液的pH约为7.4 |
您最近一年使用:0次
2022-01-26更新
|
194次组卷
|
2卷引用:浙江省绍兴柯桥区2021-2022学年高二上学期期末教学质量调测化学试题



