名校
1 . 常温下,量取10.00mL 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
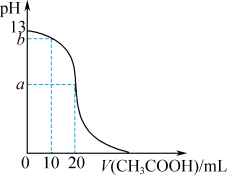
 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
A. 溶液的浓度为 溶液的浓度为 |
B. |
C.当 时,溶液中存在 时,溶液中存在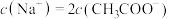 |
D. 、 、 两点对应溶液中,由水电离出的 两点对应溶液中,由水电离出的 a>b a>b |
您最近半年使用:0次
2024-02-10更新
|
85次组卷
|
2卷引用:四川省内江市资中县第二中学2023-2024学年高二上学期12月月考化学试题
名校
2 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、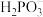 、
、 的物质的量分数
的物质的量分数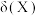 随
随 的变化如图所示。已知:
的变化如图所示。已知: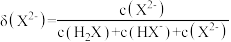 。
。
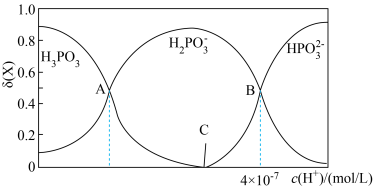
①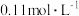 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点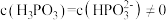 ,那C点对应的
,那C点对应的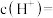
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中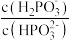 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
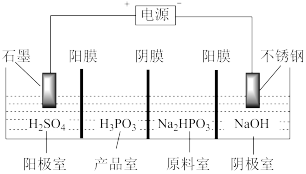
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、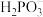 、
、 的物质的量分数
的物质的量分数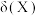 随
随 的变化如图所示。已知:
的变化如图所示。已知: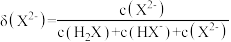 。
。
①
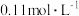 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
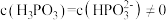 ,那C点对应的
,那C点对应的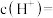
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中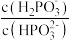 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近半年使用:0次
名校
解题方法
3 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
I.常温下,一定浓度的 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数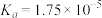 。
。
(1)乙酸钠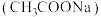 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。 的
的 溶液中:
溶液中: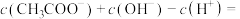
_______  。
。
Ⅱ.常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。

(2)在常温下 的电离平衡常数
的电离平衡常数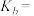
_______ (用含有a的代数式表示)。
Ⅲ. 时,向
时,向 溶液中滴加
溶液中滴加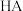 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:

(3)根据该图判断HA为_______ (填“强酸”或“弱酸”),理由是_______ 。
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会_______ (填“增大”、“减小”或“不变”)。
(5)d点溶液中溶质成分是_______ ,溶液中离子浓度大小关系_______ 。
I.常温下,一定浓度的
 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数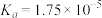 。
。(1)乙酸钠
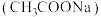 溶液呈碱性的原因是
溶液呈碱性的原因是 的
的 溶液中:
溶液中: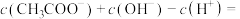
 。
。Ⅱ.常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。
(2)在常温下
 的电离平衡常数
的电离平衡常数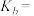
Ⅲ.
 时,向
时,向 溶液中滴加
溶液中滴加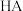 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:
(3)根据该图判断HA为
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会
(5)d点溶液中溶质成分是
您最近半年使用:0次
名校
4 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸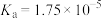 ;碳酸
;碳酸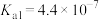 ,
,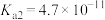 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中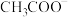 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: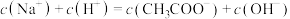
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式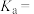
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中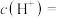
_______ mol⋅L 。(已知:
。(已知: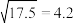 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: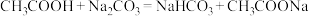
c.NaClO溶液中通入 :
: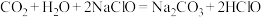
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: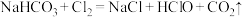
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
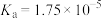 ;碳酸
;碳酸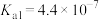 ,
,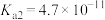 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
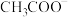 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
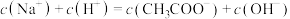
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) | 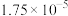 | 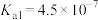 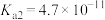 |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式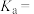
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中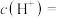
 。(已知:
。(已知: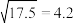 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: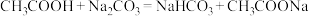
c.NaClO溶液中通入
 :
: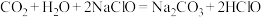
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: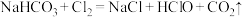
您最近半年使用:0次
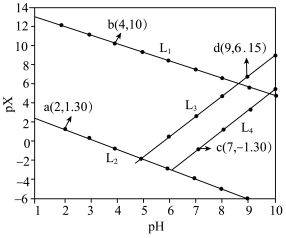
5 . 常温下,分别在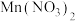 、
、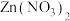 、
、 溶液中滴加NaOH溶液,溶液pX[
溶液中滴加NaOH溶液,溶液pX[ ,X代表
,X代表 、
、 、
、 ,
, ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: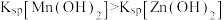 。下列叙述错误的是
。下列叙述错误的是
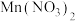 、
、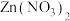 、
、 溶液中滴加NaOH溶液,溶液pX[
溶液中滴加NaOH溶液,溶液pX[ ,X代表
,X代表 、
、 、
、 ,
, ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: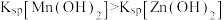 。下列叙述错误的是
。下列叙述错误的是
A.图中 代表 代表 , , 代表 代表 |
B.室温下,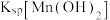 的数量级为 的数量级为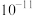 |
C.同时产生两种沉淀时,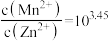 |
D.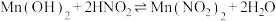 的平衡常数 的平衡常数 |
您最近半年使用:0次
2024-01-05更新
|
818次组卷
|
4卷引用:2024届河南省南阳市TOP二十名校高三上学期仿真模拟理综试题(一)
2024届河南省南阳市TOP二十名校高三上学期仿真模拟理综试题(一)河南省濮阳市油田第一中学2023-2024学年高三上学期第五次考试理科综合试题-高中化学(已下线)热点18 电解质溶液图像分析(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
6 . 化学是一门实验的科学,滴定法是一种常用的化学定量分析的方法。室温下,用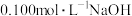 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
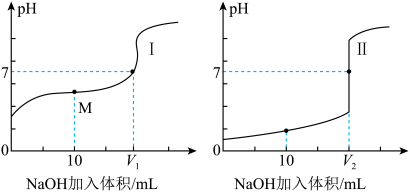
(1)滴定醋酸溶液的曲线是___________ 。(填“Ⅰ”或“Ⅱ”)。
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式___________ 。
(3)滴定开始前,三种溶液中由水电离出的 最大的是
最大的是______ 。
A.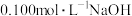 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸
(4)该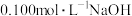 溶液的pH为
溶液的pH为______ ;给该溶液加热,pH______ (填“变大”“变小”或“不变”)。
(5)在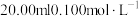 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=___________ 。
(6)取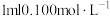 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH=___________ ,此时水电离出的 浓度为
浓度为___________ 。
(7)下列离子一定能大量共存的是___________。
(8)下列叙述正确的是___________。
(9)下列有关实验的说法,正确的是___________。
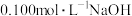 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
(1)滴定醋酸溶液的曲线是
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式
(3)滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是A.
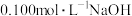 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸(4)该
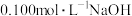 溶液的pH为
溶液的pH为(5)在
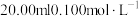 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=(6)取
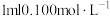 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH= 浓度为
浓度为(7)下列离子一定能大量共存的是___________。
A.甲基橙呈黄色的溶液中: 、 、 、 、 、 、 |
B.加入铝粉后产生大量氢气的溶液中: 、 、 、 、 、 、 |
C.石蕊呈蓝色的溶液中: 、 、 、 、 、 、 |
D.pH=1的溶液中: 、 、 、 、 、 、 |
(8)下列叙述正确的是___________。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下其 |
B.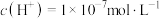 的溶液一定是中性溶液 的溶液一定是中性溶液 |
C.向水中加入少量固体 ,水的电离平衡逆向移动, ,水的电离平衡逆向移动, 减小 减小 |
D.将水加热, 增大,pH不变 增大,pH不变 |
(9)下列有关实验的说法,正确的是___________。
| A.测定HClO溶液pH时,用玻璃棒蘸取溶液,点在干燥pH试纸上 |
| B.等体积、等pH的硫酸与醋酸溶液分别与足量锌反应,醋酸产生的氢气多 |
| C.等体积、等浓度的盐酸和醋酸分别与相同大小的锌粒反应,醋酸初始反应速率快 |
| D.使用pH试纸测定溶液的pH时,若先润湿,则测得溶液的pH一定有误差 |
您最近半年使用:0次
名校
解题方法
7 . 化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵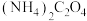 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于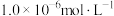 )时,溶液中
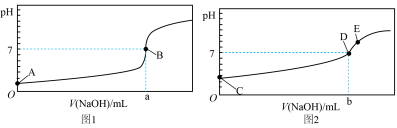
)时,溶液中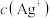 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
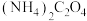 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于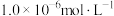 )时,溶液中
)时,溶液中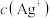 为
为 (已知
(已知 )。
)。
您最近半年使用:0次
2023-12-18更新
|
294次组卷
|
2卷引用:上海市七宝中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . Ⅰ. 下的某溶液中,
下的某溶液中,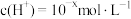 ,
,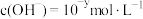 ,
, 与
与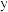 的关系如下图所示:
的关系如下图所示:
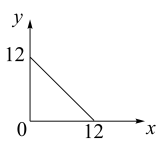
(1)在此温度下,向 溶液中逐滴加入
溶液中逐滴加入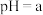 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:
假设溶液混合前后的体积变化忽略不计,则
_______ ,实验②中由水电离产生的
_______  。
。
(2)在此温度下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为_______ 。
Ⅱ.在保持体系总压为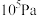 的条件下进行反应:
的条件下进行反应: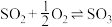 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度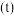 的关系如图所示:
的关系如图所示:

(3)图中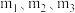 的大小顺序为
的大小顺序为_______ 。
(4)图中A点原料气的成分: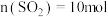 ,
,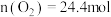 ,
, ,达平衡时
,达平衡时 的分压
的分压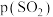 为
为_______ 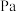 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
(5)若在容积均为2L的密闭容器内, 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: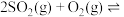
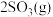
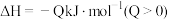 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
三个容器中的反应分别达平衡时下列各组数据关系正确的是_______(填字母)。
Ⅲ. 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: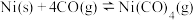
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和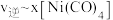 的关系如图所示:
的关系如图所示:
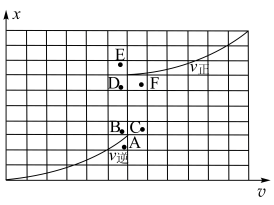
(6)当降低温度时,反应重新达到平衡, 和
和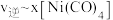 相对应的点分别为
相对应的点分别为_______ 、_______ (填字母)。
 下的某溶液中,
下的某溶液中,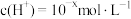 ,
,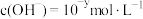 ,
, 与
与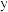 的关系如下图所示:
的关系如下图所示:
(1)在此温度下,向
 溶液中逐滴加入
溶液中逐滴加入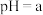 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |


 。
。(2)在此温度下,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为Ⅱ.在保持体系总压为
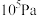 的条件下进行反应:
的条件下进行反应: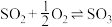 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度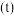 的关系如图所示:
的关系如图所示:
(3)图中
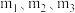 的大小顺序为
的大小顺序为(4)图中A点原料气的成分:
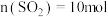 ,
,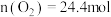 ,
, ,达平衡时
,达平衡时 的分压
的分压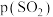 为
为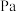 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。(5)若在容积均为2L的密闭容器内,
 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: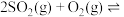
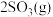
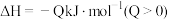 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 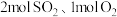 | 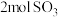 |  |
平衡时n( ) ) |  |  |  |
| 反应的能量变化 | 放出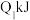 | 吸收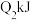 | 放出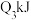 |
| 体系的压强 |  |  |  |
| 反应物的转化率 | 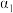 | 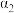 | 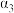 |
A.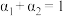 |
B.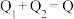 |
C. |
D. |
E. |
F.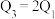 |
Ⅲ.
 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: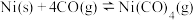
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和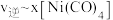 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡,
 和
和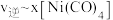 相对应的点分别为
相对应的点分别为
您最近半年使用:0次
解题方法
9 . 草酸 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中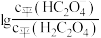 或
或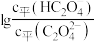 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中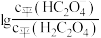 或
或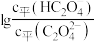 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.草酸的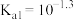 | B.水的电离程度 |
C. 点时, 点时, | D.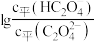 随溶液 随溶液 的变化为曲线Ⅱ 的变化为曲线Ⅱ |
您最近半年使用:0次
2023-12-03更新
|
309次组卷
|
2卷引用:山东省日照市2023-2024学年高二上学期期中校际联合考试化学试题
名校
解题方法
10 . 已知 ℃时,
℃时,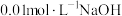 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,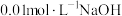 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.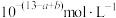 | B. |
C.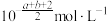 | D.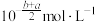 |
您最近半年使用:0次
2023-11-12更新
|
464次组卷
|
3卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题



