名校
解题方法
1 . 下列各组离子在指定溶液中一定能大量共存的是
A.滴入甲基橙显红色的溶液: 、 、 、 、 、 、 |
B.室温下,水电离的 mol/L的溶液: mol/L的溶液: 、 、 、 、 、 、 |
C.室温下, 的溶液: 的溶液: 、 、 、 、 、 、 |
D.室温下,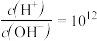 的溶液: 的溶液: 、 、 、 、 、 、 |
您最近一年使用:0次
2022-12-29更新
|
368次组卷
|
2卷引用:辽宁省大连市2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 常温下,下列各组离子一定能大量共存的是
A.0.1mol•L-1的NaHCO3溶液中:Fe3+、K+、Cl-、 |
B.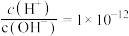 的溶液中:K+、Na+、 的溶液中:K+、Na+、 、 、 |
C.滴加KSCN溶液显红色的溶液中: 、K+、Cl-、I- 、K+、Cl-、I- |
D.水电离产生的c(OH-)=1.0×10-12mol•L-1的溶液中:Na+、Al3+、Cl-、 |
您最近一年使用:0次
名校
解题方法
3 . 某温度下,向10mL0.01mol/LPbCl2溶液中滴加0.01mol/L的Na2S溶液,滴加过程中lgc(Pb2+)与Na2S溶液体积的关系如图所示,下列有关说法正确的是
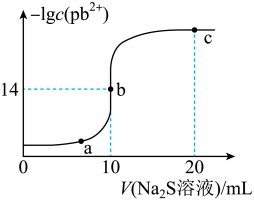
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2

已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2
| A.a、b、c三点对应的溶液中,水的电离程度最小的为a点 |
| B.Na2S溶液中:c(Na+)=c(H2S)+2c(S2-)+c(HS-) |
| C.向Zn2+、Pb2+浓度相等的混合溶液中逐滴加入一定浓度的Na2S溶液,Zn2+先沉淀 |
| D.若改用0.005mol/LNa2S溶液,b点应该水平右移 |
您最近一年使用:0次
2022-11-18更新
|
522次组卷
|
3卷引用:辽宁省六校协作体2022-2023学年高二上学期期中考试化学试题
4 . 按要求填空。
(1)已知室温时, 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中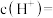
_______  。
。
②HA的电离平衡常数K=_______ 。
③由HA电离出的 约为水电离出的
约为水电离出的 的
的_______ 倍。
(2)部分弱酸的电离平衡常数如下表:
按要求回答下列问题:
①HCOOH、 、
、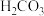 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为_______ 。
②同浓度的 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
③运用上述电离常数及物质的特性写出下列反应的离子方程式
i. 溶液中通入过量
溶液中通入过量
_______ 。
ii.过量 通入NaClO溶液中
通入NaClO溶液中_______ 。
(3)已知 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: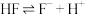 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是_______ (填标号)。
①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
(1)已知室温时,
 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:①该溶液中
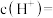
 。
。②HA的电离平衡常数K=
③由HA电离出的
 约为水电离出的
约为水电离出的 的
的(2)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH |  | 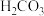 | HClO |
| 电离平衡常数(25℃) | 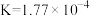 | 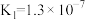 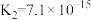 | 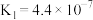 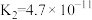 | 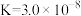 |
①HCOOH、
 、
、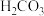 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为②同浓度的
 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为③运用上述电离常数及物质的特性写出下列反应的离子方程式
i.
 溶液中通入过量
溶液中通入过量
ii.过量
 通入NaClO溶液中
通入NaClO溶液中(3)已知
 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: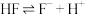 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
您最近一年使用:0次
2022-11-16更新
|
280次组卷
|
2卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 已知水的电离平衡曲线如图所示:
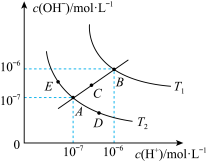
试回答下列问题:
(1)图中
_______  (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)
(2)图中五点的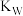 间的关系是
间的关系是_______ 。
(3)若从A点到E点,可采用的措施是_______ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
(5)点B对应的温度下,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积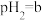 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的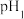 与强碱的
与强碱的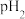 之间应满足的关系是
之间应满足的关系是_______ 。
(6)写出用pH试纸测溶液pH的操作_______ 。

试回答下列问题:
(1)图中

 (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)(2)图中五点的
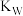 间的关系是
间的关系是(3)若从A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(5)点B对应的温度下,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积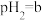 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的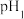 与强碱的
与强碱的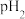 之间应满足的关系是
之间应满足的关系是(6)写出用pH试纸测溶液pH的操作
您最近一年使用:0次
2022-11-10更新
|
345次组卷
|
3卷引用:山东省菏泽市2022-2023学年高二上学期期中考试(B)化学试题
名校
解题方法
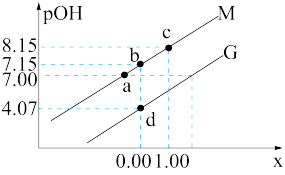
6 .  是一种可溶于水的二元弱碱,在水中能电离出
是一种可溶于水的二元弱碱,在水中能电离出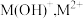 。已知
。已知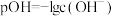 。常温下,向
。常温下,向 溶液中滴加某浓度的硫酸溶液,调节
溶液中滴加某浓度的硫酸溶液,调节 的值,测得溶液的
的值,测得溶液的 随x{
随x{ 或
或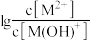 }的变化关系如图所示。下列说法正确的是
}的变化关系如图所示。下列说法正确的是
 是一种可溶于水的二元弱碱,在水中能电离出
是一种可溶于水的二元弱碱,在水中能电离出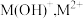 。已知
。已知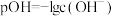 。常温下,向
。常温下,向 溶液中滴加某浓度的硫酸溶液,调节
溶液中滴加某浓度的硫酸溶液,调节 的值,测得溶液的
的值,测得溶液的 随x{
随x{ 或
或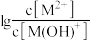 }的变化关系如图所示。下列说法正确的是
}的变化关系如图所示。下列说法正确的是
| A.溶液中水的电离程度:a点大于b点 |
B.曲线M代表 与 与 的变化关系 的变化关系 |
C.常温下,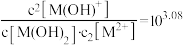 |
D.b点处有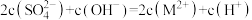 |
您最近一年使用:0次
解题方法
7 . 已知水在25℃和95℃时,其电离平衡曲线如图所示:
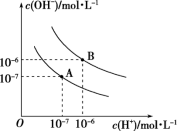
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
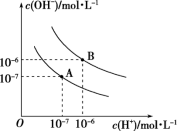
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
您最近一年使用:0次
名校
解题方法
8 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
9 . 常温下,下列关于溶液的说法错误的是
A.某盐溶液pH<7,则此溶液中水电离的 浓度大于 浓度大于 |
B.pH均为3的 和HCl溶液的导电能力基本相同 和HCl溶液的导电能力基本相同 |
C.0.1mol/L的氨水pH约为11,则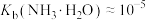 |
D.将 溶液稀释,pH减小 溶液稀释,pH减小 |
您最近一年使用:0次
名校
10 . 某温度下,改变0.1mol/L  溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知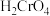 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
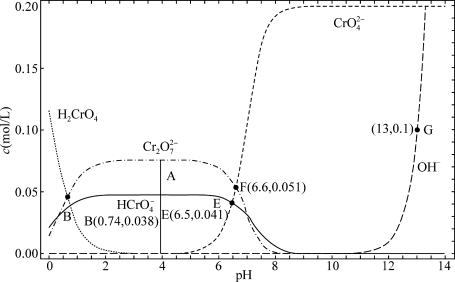
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知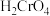 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
A.该温度下的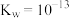 |
B.溶液中存在平衡 ,该温度下此反应的 ,该温度下此反应的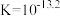 |
C.向0.1mol/L  溶液中加入一定量NaOH固体,溶液橙色变浅 溶液中加入一定量NaOH固体,溶液橙色变浅 |
D.E点溶液中存在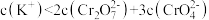 |
您最近一年使用:0次



