名校
1 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸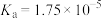 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: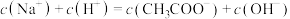
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: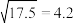 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: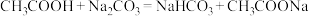
c.NaClO溶液中通入 :
: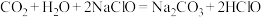
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: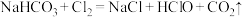
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
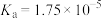 ;碳酸
;碳酸 ,
, 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
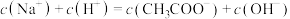
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  |   |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。(已知:
。(已知: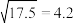 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: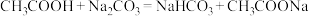
c.NaClO溶液中通入
 :
: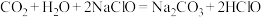
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: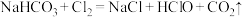
您最近一年使用:0次
2 . 按要求填空。
(1)已知室温时, 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中
_______  。
。
②HA的电离平衡常数K=_______ 。
③由HA电离出的 约为水电离出的
约为水电离出的 的
的_______ 倍。
(2)部分弱酸的电离平衡常数如下表:
按要求回答下列问题:
①HCOOH、 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为_______ 。
②同浓度的 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
③运用上述电离常数及物质的特性写出下列反应的离子方程式
i. 溶液中通入过量
溶液中通入过量
_______ 。
ii.过量 通入NaClO溶液中
通入NaClO溶液中_______ 。
(3)已知 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: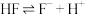 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是_______ (填标号)。
①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
(1)已知室温时,
 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:①该溶液中

 。
。②HA的电离平衡常数K=
③由HA电离出的
 约为水电离出的
约为水电离出的 的
的(2)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH |  |  | HClO |
| 电离平衡常数(25℃) | 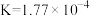 | 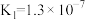 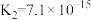 | 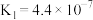 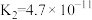 | 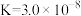 |
①HCOOH、
 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为②同浓度的
 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为③运用上述电离常数及物质的特性写出下列反应的离子方程式
i.
 溶液中通入过量
溶液中通入过量
ii.过量
 通入NaClO溶液中
通入NaClO溶液中(3)已知
 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: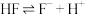 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
您最近一年使用:0次
2022-11-16更新
|
280次组卷
|
2卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
3 . 常温下,有以下五种溶液:
请回答以下问题:
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①_______ (填“>”、“<”或“=”)v②,若收集等体积的 ,则消耗时间更短的是
,则消耗时间更短的是_______ (填化学式),醋酸和锌反应的离子方程式为_______ 。
(2)若向⑤溶液中加入少量④,⑤的 将
将_______ (填“增大”、“减小”或“不变”,下同);若加入少量②,⑤的水解程度将_______ 。
(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的 由大到小的顺序是
由大到小的顺序是_______ (填编号)。
(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是_______ (填化学名称)。
(5)将等体积的①和②溶液混合后,加入 蒸馏水,溶液中
蒸馏水,溶液中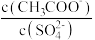 将
将_______ (填“增大”、“减小”或“不变”)。
(6)①,②,③,④,⑤五种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是_______ (填编号)。
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 醋酸 | 硫酸 | 氨水 | 氢氧化钠 | 氯化铵 |
 | 3 | 3 | 11 | 11 | 3 |
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①
 ,则消耗时间更短的是
,则消耗时间更短的是(2)若向⑤溶液中加入少量④,⑤的
 将
将(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的
 由大到小的顺序是
由大到小的顺序是(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是
(5)将等体积的①和②溶液混合后,加入
 蒸馏水,溶液中
蒸馏水,溶液中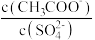 将
将(6)①,②,③,④,⑤五种溶液中由水电离出的
 浓度由大到小的顺序是
浓度由大到小的顺序是
您最近一年使用:0次
2022-01-15更新
|
164次组卷
|
2卷引用:河北省定州市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
4 . 盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示明矾可作净水剂的原因:_______ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_______ 。
(3)物质的量浓度相等的下列溶液①NH4Cl;②NH4HSO4;③(NH4)2SO4;④CH3COONH4;⑤NH3·H2O,溶液中的pH由大到小的顺序是_______ (用序号表示)
(4)25℃,两种酸的电离平衡常数如下表:
①0.10mol/L NaHSO3溶液中离子浓度由大到小的顺序为_______ ;
②向Na2S溶液中通入足量二氧化硫时反应的离子方程式_______ 。
③向NaHS溶液中通入少量CO2时反应的离子方程式_______ 。
(1)用离子方程式表示明矾可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)物质的量浓度相等的下列溶液①NH4Cl;②NH4HSO4;③(NH4)2SO4;④CH3COONH4;⑤NH3·H2O,溶液中的pH由大到小的顺序是
(4)25℃,两种酸的电离平衡常数如下表:
| H2SO3 | H2CO3 | H2S | |
| Ka1 | 1.3×10-2 | 4.2×10-7 | 1.9×10-8 |
| Ka2 | 6.3×10-8 | 5.6×10-11 | 1.0×10-12 |
①0.10mol/L NaHSO3溶液中离子浓度由大到小的顺序为
②向Na2S溶液中通入足量二氧化硫时反应的离子方程式
③向NaHS溶液中通入少量CO2时反应的离子方程式
您最近一年使用:0次
5 . 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-12-19更新
|
98次组卷
|
2卷引用:江西省抚州市南城县第二中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
6 . 现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________ (填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______ (填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______ 。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________ ;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____ (填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________ 。
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=
您最近一年使用:0次
7 . 应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式:_____________ 。
(2)明矾净水的原理为(用离子方程式表示)____________________________ 。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________ 。
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______ 。
(1)写出醋酸(CH3COOH) 的电离方程式:
(2)明矾净水的原理为(用离子方程式表示)
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是
(5)常温下,下列事实能证明HA是弱电解质的是
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为
您最近一年使用:0次
名校
8 . 今年春天以来,内蒙古自治区降水较常年偏少、气温偏高。进入7月以后,全区过半地域最高温度超过30℃以上,中西部地区有17个站点,最高温度超过35℃,阿拉善盟极高温度达到40℃。旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是______________________ 。
(2)在由水电离产生的c(H+)=1×10-14molL-1的溶液中①NH4+、A13+、Br-、SO42-;②Na+、Mg2+、Cl-、NO3-;③K+、Ba2+、Cl-、NO3-;④K+、 Na+、HCO3-、SO42-四组离子中。一定可以大量共存的是______ (填序号,下同),可能大量共存的是_____________ 。
(3)在下列中,水既不作氧化剂又不作还原剂是_____________ (填序号)。
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O==4NaOH+O2↑
C.CaH2+2H2O==Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)将钠、钾分别投入有少量相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为_____________ 。
(5)三氟化氮(NF3)是一种无色无味的气体,27.0mL NF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:_________________ 。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是
(2)在由水电离产生的c(H+)=1×10-14molL-1的溶液中①NH4+、A13+、Br-、SO42-;②Na+、Mg2+、Cl-、NO3-;③K+、Ba2+、Cl-、NO3-;④K+、 Na+、HCO3-、SO42-四组离子中。一定可以大量共存的是
(3)在下列中,水既不作氧化剂又不作还原剂是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O==4NaOH+O2↑
C.CaH2+2H2O==Ca(OH)2+2H2↑ D.3Fe+4H2O
 Fe3O4+4H2
Fe3O4+4H2(4)将钠、钾分别投入有少量相同质量的稀H2SO4中,反应结束后,两种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为
(5)三氟化氮(NF3)是一种无色无味的气体,27.0mL NF3和水充分反应,生成18.0mLNO(同温、同压下),写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________ 。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是_______
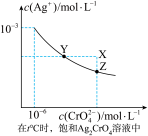
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______ 。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
(1)用离子方程式表示FeCl3可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是

A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是
您最近一年使用:0次
名校
解题方法
10 . 请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______ mol·L-1,Kw(25℃)________ Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____ (填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________ ;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________ c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
①HSO3-的电离平衡常数表达式K=_________ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________ 。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)
(3)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
2017-04-07更新
|
511次组卷
|
2卷引用:2016-2017学年福建省泉州市南安第一中学高二下学期第一次阶段考试(3月)化学试卷



