研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸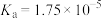 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
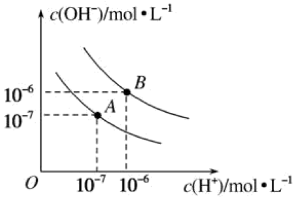
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: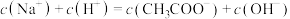
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: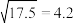 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: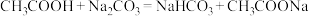
c.NaClO溶液中通入 :
: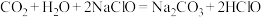
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: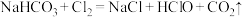
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
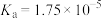 ;碳酸
;碳酸 ,
, 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
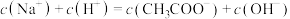
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  |   |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。(已知:
。(已知: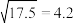 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: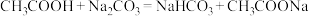
c.NaClO溶液中通入
 :
: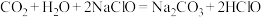
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: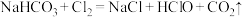
更新时间:2024-01-06 21:54:26
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1) 时,
时, 的
的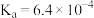 ,则此温度下
,则此温度下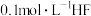 溶液的
溶液的 为
为_______  。
。
(2) 时,
时,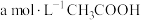 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
_______ 。
(3)硒酸( )在水溶液中的电离如下:
)在水溶液中的电离如下: 。向
。向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为_______ 。
(4)已知 时,
时,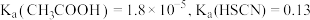 。现在该温度下将
。现在该温度下将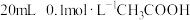 溶液和
溶液和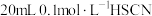 溶液分别与
溶液分别与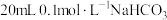 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是_______ 。

(5)已知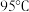 时的
时的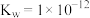 ,将
,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得
溶液混合,若所得 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为_______ 。
(6)常温下,由水电离出的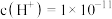 ,则该溶液的
,则该溶液的 为
为_______ 。
(1)
 时,
时, 的
的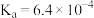 ,则此温度下
,则此温度下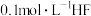 溶液的
溶液的 为
为 。
。(2)
 时,
时,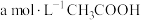 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
(3)硒酸(
 )在水溶液中的电离如下:
)在水溶液中的电离如下: 。向
。向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为(4)已知
 时,
时,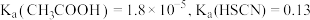 。现在该温度下将
。现在该温度下将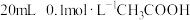 溶液和
溶液和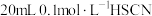 溶液分别与
溶液分别与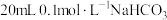 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是
(5)已知
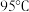 时的
时的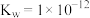 ,将
,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得
溶液混合,若所得 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(6)常温下,由水电离出的
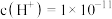 ,则该溶液的
,则该溶液的 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示。
(1)25 ℃时水的电离平衡曲线应为_______ (填“A”或“B”)。25 ℃时,将pH=9的 NaOH 溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则 NaOH 溶液与 H2SO4溶液的体积比为 _______ 。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_______ 。
(3)在曲线 A 所对应的温度下,pH=2的 HCl溶液和pH=11的某BOH 溶液中,若水的电离程度分别用α1、α2表示,则α1_______ α2(填“大于”“小于”“等于”“无法确定”)
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=_______
(5)已知 HClO 的 Ka=2.98×10-8,CH3COOH 的 Ka=1.75×10-5,下列有关说法不正确的是

(1)25 ℃时水的电离平衡曲线应为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
(3)在曲线 A 所对应的温度下,pH=2的 HCl溶液和pH=11的某BOH 溶液中,若水的电离程度分别用α1、α2表示,则α1
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
(5)已知 HClO 的 Ka=2.98×10-8,CH3COOH 的 Ka=1.75×10-5,下列有关说法不正确的是
| A.在pH=2的醋酸溶液中加入少量0.01mol·L-1的稀盐酸,溶液的pH 不变 |
| B.在pH=2的醋酸溶液中加少量水,能促进醋酸的电离平衡,但是溶液的pH 会变大 |
| C.100mL pH=2的新制氯水中:n(OH- )+n(ClO-)+n(HClO)=0.001mol |
| D.由电离平衡常数分析,CH3COOH 溶液的pH 一定比 HClO 溶液的pH 小 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______ 。
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH_______ 7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,水电出的c(H+)=_______ 。
(3)25 ℃时,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH=_______ 。
(4)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
①负极材料是_______ (写名称)。
②正极电极反应式为_______ 。
③溶液中SO 向
向_______ 极移动。
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH
(3)25 ℃时,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH=
(4)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
①负极材料是
②正极电极反应式为
③溶液中SO
 向
向
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】常温下,几种常见的弱酸的电离平衡常数如下表所示:
(1)写出Na2CO3溶液中滴入少量CH3COOH溶液的离子方程式_______ 。
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______ 。
(3)下列说法中不正确的是
(4)下列措施中,能减小CH3COONa溶液中CH3COO-水解程度的是_______
A.加入少量冰醋酸
B.升温
C.通入少量HCl
D.加入少量CH3COONa固体
E.加水稀释
| 酸 | CH3COOH | HClO | H2SO3 | H2CO3 |
| 电离平衡常数 | 1.75 × 10-5 | 4.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 | Ka1=4.5×10-7 Ka2=-4.7×10-11 |
(2)用离子方程式表示Na2SO3溶液显碱性的原因
(3)下列说法中不正确的是
| A.已知漂白性:HClO>ClO-,漂白粉配制成溶液后放置在空气中,一段时间后漂白性会增强 |
| B.常温下,浓度均为0.1 mol/L的三种溶液: CH3COONa、NaClO、Na2CO3溶液中,碱性最强的是Na2CO3 |
C.已知NaHSO3溶液显酸性,则其中c(H2SO3)>c( ) ) |
| D.常温下,浓度均为0.1 mol/L的HClO和H2SO3溶液混合,溶液酸性会增强 |
A.加入少量冰醋酸
B.升温
C.通入少量HCl
D.加入少量CH3COONa固体
E.加水稀释
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。回答下列问题:
(1)钠碱循环法中,吸收液为Na2SO3溶液,其中各离子浓度由大到小的顺序为__ 。
(2)可用Na2SO3溶液吸收SO2制备NaHSO3,该反应的离子方程式是__ 。
(3)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列各组微粒可以大量共存的是__ (填字母)。
A.CO 和HSO
和HSO B.HCO
B.HCO 和HSO
和HSO C.SO
C.SO 和HCO
和HCO D.H2SO3和HCO
D.H2SO3和HCO
(4)吸收液吸收SO2的过程中,水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图:
随pH的分布如图:
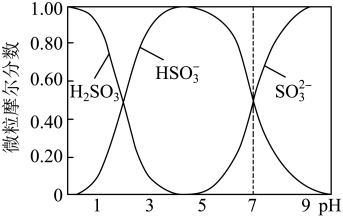
①在0.1mol/LNaHSO3溶液中粒子浓度关系不正确的是__ (填字母)。
A.c(Na+)=2c(SO )+c(HSO
)+c(HSO )+c(H2SO3)
)+c(H2SO3)
B.c(H+)-c(OH-)=c(SO )-c(H2SO3)
)-c(H2SO3)
C.c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3)
)>c(H2SO3)
D.c(Na+)+c(H+)=2c(SO )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
②根据图计算反应SO +H2O
+H2O HSO
HSO +OH-的水解常数值
+OH-的水解常数值___ 。
③室温下,向一定量的漂白液(主要成分NaClO)中滴加适量的NaHSO3溶液,该过程中溶液pH的变化是___ (“增大”“减小”“不变”)。写出该反应的离子方程式__ 。
(5)泡沫灭火器内外桶中各盛有一定浓度的NaHCO3、Al2(SO4)3溶液。使用时须将该灭火器反转并拔掉插销,让上述溶液混合并由喷嘴喷射出一定量的气流和难溶物,覆盖在可燃物的表面起到灭火效果。
①写出该反应的离子方程式___ 。
②泡沫灭火器可适合于扑灭下列哪种物品的初期着火__ 。(填序号)
A.植物油 B.Na、K着火 C.家用电器 D.棉纱纸张
(1)钠碱循环法中,吸收液为Na2SO3溶液,其中各离子浓度由大到小的顺序为
(2)可用Na2SO3溶液吸收SO2制备NaHSO3,该反应的离子方程式是
(3)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列各组微粒可以大量共存的是
A.CO
 和HSO
和HSO B.HCO
B.HCO 和HSO
和HSO C.SO
C.SO 和HCO
和HCO D.H2SO3和HCO
D.H2SO3和HCO
(4)吸收液吸收SO2的过程中,水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图:
随pH的分布如图:
①在0.1mol/LNaHSO3溶液中粒子浓度关系不正确的是
A.c(Na+)=2c(SO
 )+c(HSO
)+c(HSO )+c(H2SO3)
)+c(H2SO3)B.c(H+)-c(OH-)=c(SO
 )-c(H2SO3)
)-c(H2SO3)C.c(Na+)>c(HSO
 )>c(SO
)>c(SO )>c(H2SO3)
)>c(H2SO3)D.c(Na+)+c(H+)=2c(SO
 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)②根据图计算反应SO
 +H2O
+H2O HSO
HSO +OH-的水解常数值
+OH-的水解常数值③室温下,向一定量的漂白液(主要成分NaClO)中滴加适量的NaHSO3溶液,该过程中溶液pH的变化是
(5)泡沫灭火器内外桶中各盛有一定浓度的NaHCO3、Al2(SO4)3溶液。使用时须将该灭火器反转并拔掉插销,让上述溶液混合并由喷嘴喷射出一定量的气流和难溶物,覆盖在可燃物的表面起到灭火效果。
①写出该反应的离子方程式
②泡沫灭火器可适合于扑灭下列哪种物品的初期着火
A.植物油 B.Na、K着火 C.家用电器 D.棉纱纸张
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知亚磷酸( )是二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定浓度的NaOH溶液,混合溶液的pH与离子浓度的关系如图所示:
)是二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定浓度的NaOH溶液,混合溶液的pH与离子浓度的关系如图所示:
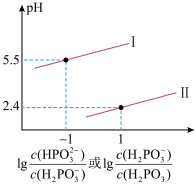
(1)请写出 的电离方程式
的电离方程式_______ 。
(2)向 溶液中滴加NaOH溶液至过量,滴加过程中水的电离程度
溶液中滴加NaOH溶液至过量,滴加过程中水的电离程度_______ 。
(3)当NaOH与 等物质的量混合时,溶液中的电荷守恒式为
等物质的量混合时,溶液中的电荷守恒式为_______ ,溶液中各离子浓度由大到小的顺序_______ 。
(4)由图分析,表示pH与 的变化关系是曲线
的变化关系是曲线_______ (填“I”或“II”)。
(5) 溶液中存在水解反应
溶液中存在水解反应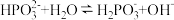 ,常温下该反应的化学平衡常数为
,常温下该反应的化学平衡常数为_______  。
。
 )是二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定浓度的NaOH溶液,混合溶液的pH与离子浓度的关系如图所示:
)是二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定浓度的NaOH溶液,混合溶液的pH与离子浓度的关系如图所示:
(1)请写出
 的电离方程式
的电离方程式(2)向
 溶液中滴加NaOH溶液至过量,滴加过程中水的电离程度
溶液中滴加NaOH溶液至过量,滴加过程中水的电离程度(3)当NaOH与
 等物质的量混合时,溶液中的电荷守恒式为
等物质的量混合时,溶液中的电荷守恒式为(4)由图分析,表示pH与
 的变化关系是曲线
的变化关系是曲线(5)
 溶液中存在水解反应
溶液中存在水解反应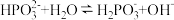 ,常温下该反应的化学平衡常数为
,常温下该反应的化学平衡常数为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________ 。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________________ 。
(3)液氨的电离类似于水,试写出液氨的电离方程式________________________________ ;在液氨中加入NH4Cl,平衡将向________ 移动。
(1)有一种溶液除H+、OH-外,还有Na+、SO
 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理
(3)液氨的电离类似于水,试写出液氨的电离方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)适量 在1mol
在1mol 中完全燃烧,生成2mol
中完全燃烧,生成2mol ,放出571.6kJ的热量。请写出表示
,放出571.6kJ的热量。请写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式______ 。
(2)电解稀的氢氧化钠溶液:阳极反应式为______ 。
(3)若向氨水中加入稀硫酸至溶液的 ,此时溶液中
,此时溶液中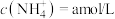 ,则
,则 =
=______ 。
(4)写出基态As原子的简化电子排布式和价层电子的轨道表示式:______ 。
(1)适量
 在1mol
在1mol 中完全燃烧,生成2mol
中完全燃烧,生成2mol ,放出571.6kJ的热量。请写出表示
,放出571.6kJ的热量。请写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)电解稀的氢氧化钠溶液:阳极反应式为
(3)若向氨水中加入稀硫酸至溶液的
 ,此时溶液中
,此时溶液中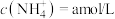 ,则
,则 =
=(4)写出基态As原子的简化电子排布式和价层电子的轨道表示式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】NH4Al(SO4)2在食品、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是____________________ (用离子方程式表示)。
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c( )
)_____ 0.1mol/LNH4HSO4溶液中c( )(填“大于”、“等于”或“小于”)。
)(填“大于”、“等于”或“小于”)。
(3)下图是0.1mol/L电解质溶液的pH 随温度变化的图象。
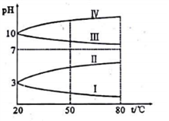
①其中符合0.1mol/LNH4Al(SO4)2溶液的是________ (填字母)。导致溶液pH随温度变化的原因是_____________________________ 。
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c( )-c(
)-c( ) -3c(Al3+)=
) -3c(Al3+)=_____ mol/L。
(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:
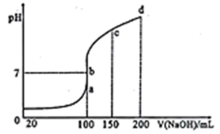
①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=_______ ,试分析图中a、b、c、d四点,水的电离程度最大的是______________________ 。
②在b点,溶液中各离子浓度由大到小的顺序是_______________ 。
③b~c段随着NaOH的加入,溶液中 的值
的值_____ (填“增大”、“减小”或 “不变”)。
(1)NH4Al(SO4)2可做净水剂,其理由是
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(
 )
) )(填“大于”、“等于”或“小于”)。
)(填“大于”、“等于”或“小于”)。(3)下图是0.1mol/L电解质溶液的pH 随温度变化的图象。

①其中符合0.1mol/LNH4Al(SO4)2溶液的是
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c(
 )-c(
)-c( ) -3c(Al3+)=
) -3c(Al3+)=(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:

①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=
②在b点,溶液中各离子浓度由大到小的顺序是
③b~c段随着NaOH的加入,溶液中
 的值
的值
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷( );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:____ ,其含有的官能团名称:____ 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是____ 。
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为____ ;故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为____ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2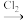
 →CH2OHCH2OH
→CH2OHCH2OH____
②CH2=CH2→ →CH2OHCH2OH
→CH2OHCH2OH____
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是____ 。
i.乙烯可在加热条件下催化氧化制得环氧乙烷(
 );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为
②防冻液在使用一段时间后pH会降低的可能原因为
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2
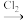
 →CH2OHCH2OH
→CH2OHCH2OH②CH2=CH2→
 →CH2OHCH2OH
→CH2OHCH2OH生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】结合相关数据,完成下列填空。
Ⅰ.常温下,叠氮酸 是一元弱酸,高锰酸
是一元弱酸,高锰酸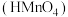 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸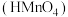 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:
(1)高铼酸属于___________ (填“强”或“弱”)酸,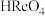 中Re的化合价为
中Re的化合价为___________ 。
(2)常温下,已知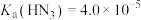 ,则
,则 的
的 溶液中
溶液中
___________  。
。
(3)已知25℃时,两种酸的电离常数如下:
请根据表格中的数据,写出足量 通到少量
通到少量 溶液中发生反应的离子方程式:
溶液中发生反应的离子方程式:___________ 。
Ⅱ.按要求完成下列表格
(4)某温度下, 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
___________ (已知该温度下 的
的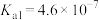 ,
,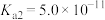 )。
)。
(5)用氨水将 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中 ,则溶液的pH为
,则溶液的pH为___________ (已知该条件下 的
的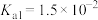 ,
, )。
)。
Ⅰ.常温下,叠氮酸
 是一元弱酸,高锰酸
是一元弱酸,高锰酸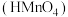 是一元强酸,
是一元强酸, 的高铼酸
的高铼酸 、
、 的高锰酸
的高锰酸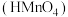 溶液分别与
溶液分别与 的
的 溶液等体积混合,所得溶液均呈中性。请回答下列问题:
溶液等体积混合,所得溶液均呈中性。请回答下列问题:(1)高铼酸属于
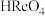 中Re的化合价为
中Re的化合价为(2)常温下,已知
 ,则
,则 的
的 溶液中
溶液中
 。
。(3)已知25℃时,两种酸的电离常数如下:
| 酸 |  |  |
 |  | 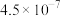 |
 通到少量
通到少量 溶液中发生反应的离子方程式:
溶液中发生反应的离子方程式:Ⅱ.按要求完成下列表格
(4)某温度下,
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的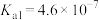 ,
,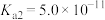 )。
)。(5)用氨水将
 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中 ,则溶液的pH为
,则溶液的pH为 的
的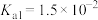 ,
, )。
)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=_______ mol∙L-1
②HA的电离平衡常数K=_______ 。
③由HA电离出的c(H+)约为水电离出的c(H+)的_______ 倍。
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
①在相同浓度的HCOOH和HClO的溶液中,溶液导电能力:HCOOH_______ HClO。
② 的电离平衡常数表达式为
的电离平衡常数表达式为_______
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式_______ 。
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=
②HA的电离平衡常数K=
③由HA电离出的c(H+)约为水电离出的c(H+)的
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
| 弱酸 | HCOOH | H2CO3 | HClO |
| 电离平衡常数/25 ℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②
 的电离平衡常数表达式为
的电离平衡常数表达式为③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
您最近一年使用:0次



