名校
解题方法
1 . 常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是
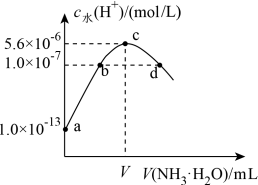

| A.V=40 |
| B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O) |
| C.NH3·H2O的电离常数K=10-4 |
D.d点所示溶液中:c(NH )=2c(SO )=2c(SO ) ) |
您最近一年使用:0次
2022-01-21更新
|
535次组卷
|
16卷引用:2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷
2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷2016届山东省临沂市高三下学期教学质检一模化学试卷2016-2017学年辽宁省沈阳铁路中学高二上第一次月考化学试卷江西省景德镇市第一中学2016-2017学年高二(素质班)下学期期末考试化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题百所名校联考-水溶液中的离子平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解中三大守恒的应用2020届高三化学选修4二轮专题练——混合溶液中微粒浓度大小的比较专题【精编23题】江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题
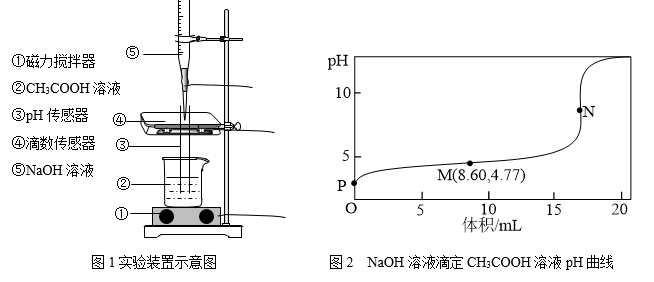
2 . 25℃下,某同学按图1所示,边用磁力搅拌器搅拌边向20.00mL浓度为 的
的 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
 的
的 溶液中逐滴加入
溶液中逐滴加入 的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
A.25℃时, 的电离常数 的电离常数 的数量级为 的数量级为 |
B.N点溶液中: |
C.水的电离程度: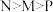 |
D.M点溶液中: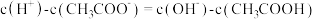 |
您最近一年使用:0次
2021-12-06更新
|
431次组卷
|
3卷引用:福建省长汀县第一中学2021-2022学年高三上学期第三次月考化学试题
福建省长汀县第一中学2021-2022学年高三上学期第三次月考化学试题河南省部分重点高中2021-2022学年高三上学期12月适应性检测化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
解题方法
3 . 在某温度时,将n mol∙L-1氨水滴入10 mL 1.0 mol∙L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
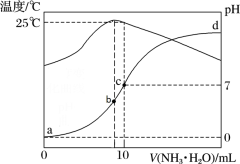

| A.a点Kw = 1.0×10-14 |
| B.b点:c(NH3∙H2O) + c(OH-) < c(H+) |
| C.25℃时,NH4Cl水解平衡常数为(n-1)×10-7(用n表示) |
| D.d点水的电离程度最大 |
您最近一年使用:0次
2021-01-07更新
|
816次组卷
|
7卷引用:福建省漳州市2021届高三毕业班适应性测试(一)化学试题
福建省漳州市2021届高三毕业班适应性测试(一)化学试题山东省济南市2021届高三上学期期中考试化学试题(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅰ卷)(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅲ卷)山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题广东省汕头市潮阳实验学校2021届高三下学期第二次月考化学试题
名校
解题方法
4 . 向1000 mL 3mol/LNaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:
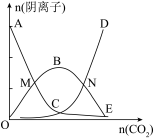
下列说法正确的是

下列说法正确的是
A.CD段反应的离子方程式为OH-+CO2=HCO |
| B.水的电离程度先增大后减小 |
| C.溶液的pH先减小后增大 |
| D.M、N两点对应的溶液中离子种类不同 |
您最近一年使用:0次
5 . 常温下,向20mL0.1mol•L-1NH4HSO4溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
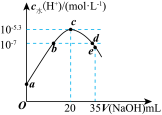

| A.c点之前,主要的反应为NH4++OH-═NH3•H2O |
| B.b点和d点对应溶液的pH均为7 |
| C.常温下,Kb(NH3•H2O)=5×10-5.4mol•L-1 |
| D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-) |
您最近一年使用:0次
19-20高三上·福建福州·期末
名校
6 . 已知: pH=-lgc(H+), pOH=-lgc(OH-)。 常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液pOH和pH变化如图所示。 下列说法正确的是
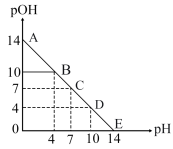

| A.盐酸与NaOH溶液的浓度相等 |
| B.B点和D点水的电离程度相同 |
| C.滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 |
| D.升高温度,滴定过程中pOH+pH>14 |
您最近一年使用:0次
2019-01-08更新
|
123次组卷
|
3卷引用:福建省福州市2019届高三年上学期期末质量抽测化学试卷
(已下线)福建省福州市2019届高三年上学期期末质量抽测化学试卷重庆市乌江新高考协作体2023-2024学年高二上学期1月期末化学试题云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________ (填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______ (填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______ 。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________ ;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____ (填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________ 。
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=
您最近一年使用:0次
名校
解题方法
8 . 请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______ mol·L-1,Kw(25℃)________ Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____ (填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________ ;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________ c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
①HSO3-的电离平衡常数表达式K=_________ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________ 。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)
(3)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
2017-04-07更新
|
511次组卷
|
2卷引用:2016-2017学年福建省泉州市南安第一中学高二下学期第一次阶段考试(3月)化学试卷



