名校
解题方法
1 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
I.常温下,一定浓度的 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数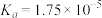 。
。
(1)乙酸钠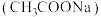 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。 的
的 溶液中:
溶液中: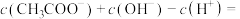
_______  。
。
Ⅱ.常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。

(2)在常温下 的电离平衡常数
的电离平衡常数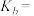
_______ (用含有a的代数式表示)。
Ⅲ. 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:

(3)根据该图判断HA为_______ (填“强酸”或“弱酸”),理由是_______ 。
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会_______ (填“增大”、“减小”或“不变”)。
(5)d点溶液中溶质成分是_______ ,溶液中离子浓度大小关系_______ 。
I.常温下,一定浓度的
 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数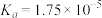 。
。(1)乙酸钠
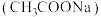 溶液呈碱性的原因是
溶液呈碱性的原因是 的
的 溶液中:
溶液中: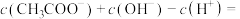
 。
。Ⅱ.常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。
(2)在常温下
 的电离平衡常数
的电离平衡常数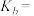
Ⅲ.
 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:
(3)根据该图判断HA为
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会
(5)d点溶液中溶质成分是
您最近一年使用:0次
名校
解题方法
2 . 25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,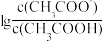 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确 的是
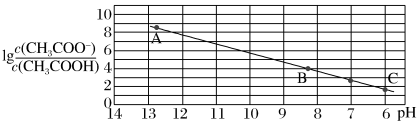
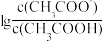 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
A.pH=11时, 的数量级为106 的数量级为106 |
| B.溶液中,水的电离程度:C >A |
| C.B点存在c(Na+)-c(CH3COO-)=(10-5.8-10-8.2)mol·L-1 |
| D.CH3COONa的水解常数Kh=10-9.7 |
您最近一年使用:0次
2022-01-14更新
|
922次组卷
|
2卷引用:安徽省黄山市2021-2022学年高三上学期第一次理科综合测试化学试题
名校
3 . 图中表示两种等体积的碱性溶液在稀释过程中pH的变化,下列相关说法正确的是
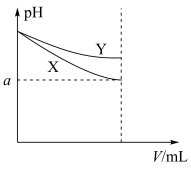

| A.两溶液稀释相同倍数,水电离的OH-浓度可能X>Y,也可能是X<Y |
| B.若图中曲线分别表示CH3COONa溶液和NaClO溶液,则X为CH3COONa溶液[已知Ka(CH3COOH)> Ka(HClO)] |
| C.加水稀释到任何程度,图中a一定大于7 |
| D.若图中曲线分别表示NaOH溶液和氨水,则起始时NaOH溶液浓度更大 |
您最近一年使用:0次
2021-11-15更新
|
884次组卷
|
6卷引用:安徽省池州市江南中学2021-2022学年高二上学期12月月考化学试题
安徽省池州市江南中学2021-2022学年高二上学期12月月考化学试题浙江省A9协作体2021-2022学年高二上学期期中联考化学试题(已下线)期末综合测试卷01-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)浙江省桐庐中学2021-2022学年高二12月阶段性测试化学试题浙江省衢温“5+1”联盟2021-2022学年高一下学期期中考试化学(创新班)试题浙江省杭州市浙江大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
4 . 下列图示与对应的叙述相符的是
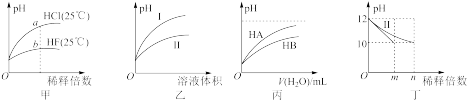

| A.由图甲可知,a点Kw的数值比b点Kw的数值大 |
| B.图乙表示用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸 |
| C.图丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度时NaA溶液的pH小于同浓度的NaB溶液的pH |
| D.图丁表示分别稀释10mLpH均为12的NaOH溶液和氨水时pH的变化,曲线I表示氨水,n>100 |
您最近一年使用:0次
2021-09-16更新
|
558次组卷
|
8卷引用:安徽省合肥市肥东县综合高中2021-2022学年高二下学期5月月考化学试题
安徽省合肥市肥东县综合高中2021-2022学年高二下学期5月月考化学试题河北正定中学2020-2021学年高二上学期第一次半月考化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.3.1 盐类水解的原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)黑龙江省双鸭山市第一中学2021-2022学年高二上学期期中考试化学试题山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题江西省吉安市遂川中学2021-2022学年高二上学期第三次月考(B)化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 . 室温下,体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)水的负对数[–lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示。下列说法正确的是
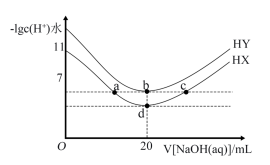

| A.室温时,Ka(HX)=10-6 |
| B.a、b、c三点溶液均显中性 |
| C.b、d两点溶液的离子总浓度不同 |
| D.c点溶液中c(X-)+c(HX)=0.1mol·L-1 |
您最近一年使用:0次
2021-03-12更新
|
1004次组卷
|
5卷引用:安徽省马鞍山市2021届高三第一次模拟理综化学试题
安徽省马鞍山市2021届高三第一次模拟理综化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题20 弱电解质的电离,水的电离,溶液pH——备战2021年高考化学经典小题考前必刷(全国通用)广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期第四次检测化学试题
6 . 常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
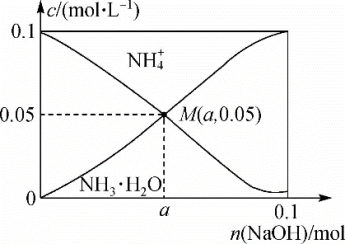
 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
| A.M点溶液中水的电离程度比原溶液大 |
| B.在M点时,n(OH-)-n(H+)=(a +0.05)mol |
C.当n(NaOH)=0.05mol时,溶液中有:c(Cl-)>c(Na+)>c(NH )>c(OH-)>c(H+ ) )>c(OH-)>c(H+ ) |
| D.随着NaOH的加入,一定存在c(Cl-)+c(OH-)+c(NH3·H2O)>0.1 mol·L-1 |
您最近一年使用:0次
2021-02-13更新
|
204次组卷
|
2卷引用:安徽省涡阳县育萃高级中学2020-2021学年高二下学期第一次月考化学试题
7 . 某二元酸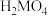 在水中分两步电离:
在水中分两步电离: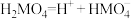 ,
, 。常温下,向20 mL
。常温下,向20 mL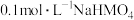 溶液中滴入
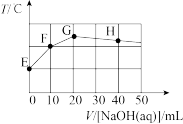
溶液中滴入 溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
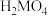 在水中分两步电离:
在水中分两步电离: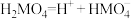 ,
, 。常温下,向20 mL
。常温下,向20 mL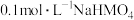 溶液中滴入
溶液中滴入 溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
| A.该NaOH溶液pH=13 |
| B.从G点到H点水的电离平衡正向移动 |
C.图象中E点对应的溶液中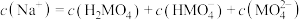 |
D.若F点对应的溶液pH=2,则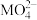 的水解平衡常数约为 的水解平衡常数约为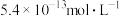 |
您最近一年使用:0次
2021-01-23更新
|
590次组卷
|
6卷引用:安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题
安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题山东省烟台市2021届高三上学期期末考试化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题
名校
解题方法
8 . 常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
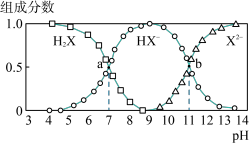

| A.水的电离程度:b点小于点a |
| B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11 |
| C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX- |
| D.常温下,反应X2-+H2O⇌HX-+OH-的平衡常数对数值1gK=-11 |
您最近一年使用:0次
2020-06-22更新
|
180次组卷
|
2卷引用:安徽师范大学附属中学2020届高三6月第九次模拟考试理综化学试题
解题方法
9 . 已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是
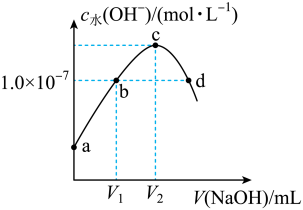

| A.V1<10,V2=20 |
| B.a点溶液的pH=3 |
| C.c点溶液c水(H+)≈1.0×10-4mol·L-1 |
| D.b、d点溶液均呈中性 |
您最近一年使用:0次



