25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,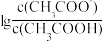 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确 的是
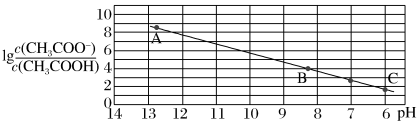
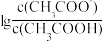 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
A.pH=11时, 的数量级为106 的数量级为106 |
| B.溶液中,水的电离程度:C >A |
| C.B点存在c(Na+)-c(CH3COO-)=(10-5.8-10-8.2)mol·L-1 |
| D.CH3COONa的水解常数Kh=10-9.7 |
更新时间:2022-01-14 20:22:10
|
相似题推荐
单选题
|
困难
(0.15)
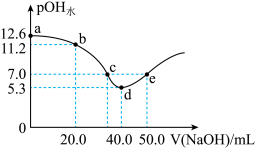
【推荐1】某二元酸 在水中的电离方程式是
在水中的电离方程式是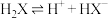 ,
, ,常温下,向20.00mL
,常温下,向20.00mL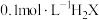 溶液中滴入
溶液中滴入 NaOH溶液,
NaOH溶液,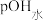 与所加NaOH溶液体积的关系如图所示。下列说法错误的是
与所加NaOH溶液体积的关系如图所示。下列说法错误的是
已知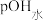 表示溶液中由水电离出的
表示溶液中由水电离出的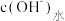 的负对数,即
的负对数,即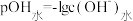 。
。
 在水中的电离方程式是
在水中的电离方程式是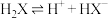 ,
, ,常温下,向20.00mL
,常温下,向20.00mL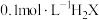 溶液中滴入
溶液中滴入 NaOH溶液,
NaOH溶液,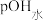 与所加NaOH溶液体积的关系如图所示。下列说法错误的是
与所加NaOH溶液体积的关系如图所示。下列说法错误的是已知
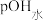 表示溶液中由水电离出的
表示溶液中由水电离出的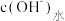 的负对数,即
的负对数,即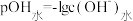 。
。
A.常温下,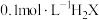 溶液的pH为1.4 溶液的pH为1.4 |
| B.溶液中水的电离程度:d>c>b |
| C.e点溶液呈碱性 |
D.d点溶液中存在: |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】常温下,将少量MSO4粉末缓慢加入20mL0.1mol·L−1H2A溶液中(已知MA难溶,忽略溶液体积变化),溶液中c(M2+)与c(H+)变化如图所示。已知:Ka1(H2A)=1.0×10-9,Ka2(H2A)=1.0×10-13,下列有关说法正确的是
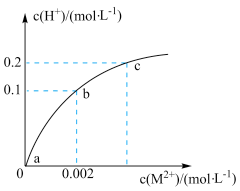
| A.a点处,由水电离产生的c(H+)≈1.0×10-5mol/L |
| B.溶液pH=7时,2c(M2+)=2c(A2-)+c(HA-) |
| C.c点处,MA的溶度积Ksp(MA)=1.0×10-24 |
| D.a、b、c三点对应的溶液中,水的电离程度大小关系:c>b>a |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐3】在25℃时,将1.0 L w mol·L-1 CH3COOH 溶液与0.1 mol NaOH固体混合,充分反应。向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH随加入CH3COOH或CH3COONa固体的物质的量的变化关系如图所示。下列叙述正确的是
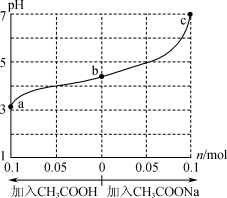

| A.b点混合液中c(H+)≥ c(OH-) + c(CH3COO-) |
B.加入CH3COOH过程中,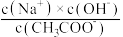 增大 增大 |
C.25℃时,CH3COOH的电离平衡常数 Ka= 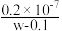 mol·L-1 mol·L-1 |
| D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐1】室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。下列说法错误的是
| 实验 | 实验操作和现象 |
| ① | 用pH试纸测定0.1 mol/L Na2SO3溶液的pH,测得pH约为10 |
| ② | 向0.1 mol/L Na2SO3溶液中通入少量SO2,测得溶液pH约为8 |
| ③ | 用pH试纸测定0.1 mol/L NaHSO3溶液的pH,测得pH约为5 |
| ④ | 向0.1 mol/L Na2SO3溶液中加入等体积等浓度的BaCl2溶液,产生白色沉淀 |
A.0.1 mol/L的Na2SO3溶液中存在:c(OH-)>c(H2SO3)+c( ) ) |
B.实验②得到的溶液中存在: c(Na+)>c(H2SO3)+c( )+c( )+c( ) ) |
| C.实验③可以得出:Ka1(H2SO3)Ka2(H2SO3)>Kw |
| D.实验④中可推测Ksp(BaSO3)>2.5×10-3 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】常温下,用相同物质的量浓度的 溶液分别滴定起始物质的量浓度均为
溶液分别滴定起始物质的量浓度均为 的三种酸溶液,滴定曲线如图所示,下列说法正确的是
的三种酸溶液,滴定曲线如图所示,下列说法正确的是
 溶液分别滴定起始物质的量浓度均为
溶液分别滴定起始物质的量浓度均为 的三种酸溶液,滴定曲线如图所示,下列说法正确的是
的三种酸溶液,滴定曲线如图所示,下列说法正确的是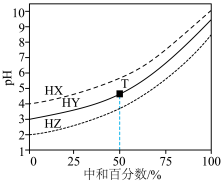
A.常温下,三种酸的电离常数: |
B.滴定至T点时,溶液中: |
C.当 时,三种酸溶液中HX溶液中和百分数最大 时,三种酸溶液中HX溶液中和百分数最大 |
D.当中和百分数达到 时,将三种溶液混合后: 时,将三种溶液混合后: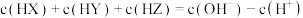 |
您最近一年使用:0次
单选题
|
困难
(0.15)
解题方法
【推荐3】乙二酸为二元弱酸,用H2A表示。25℃时,向0.1 mol·L-1的NH4HA溶液中滴加适量的盐酸或NaOH溶液,溶液中各含氮(或A)微粒的分布分数δ与溶液pH的关系如图所示(不考虑溶液中的NH3分子)。比如:溶液中H2A的分布分数δ (H2A)= 
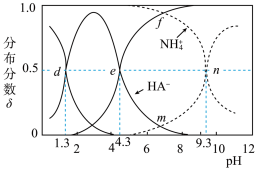
下列说法正确的是


下列说法正确的是
A.向NH4HA溶液中滴加少量NaOH溶液到m点的过程中,HA-反应的比例小于NH |
| B.f点时,溶液中c(A2- )+c(HA- )+c(OH- )=c(Na+ )+c(H+ ) |
C. = 10-3 = 10-3 |
D.在d、n点溶液中均满足c(H2A)+c(HA- )+c(A2- )=c(NH3·H2O)+c(NH )=0.1mol·L-1 )=0.1mol·L-1 |
您最近一年使用:0次
单选题
|
困难
(0.15)
解题方法
【推荐1】某无色稀溶液X中,可能含有如表所列离子中的某几种。
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(Y)的关系如图所示。下列说法正确的是
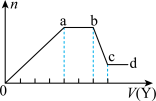
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(Y)的关系如图所示。下列说法正确的是
| 阴离子 | 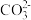 、 、 、[Al(OH)4]-、Cl- 、[Al(OH)4]-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、 、Na+ 、Na+ |

A.若Y是盐酸,则X中一定含有CO 、SiO 、SiO 、[Al(OH)4]-和NH4+ 、[Al(OH)4]-和NH4+ |
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、 、Cl- 、Cl- |
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为: +OH-=NH3↑+H2O +OH-=NH3↑+H2O |
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、 物质的量之比为2:1:4 物质的量之比为2:1:4 |
您最近一年使用:0次
单选题
|
困难
(0.15)
解题方法
【推荐2】电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在一定条件下,用 的高氯酸溶液滴定
的高氯酸溶液滴定 某弱酸酸式盐
某弱酸酸式盐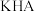 溶液,测得电压变化与滴入
溶液,测得电压变化与滴入 溶液的体积关系如图所示。做空白对照实验,消耗
溶液的体积关系如图所示。做空白对照实验,消耗 溶液的体积为
溶液的体积为 。已知N为滴定终点。下列说法正确的是
。已知N为滴定终点。下列说法正确的是

 的高氯酸溶液滴定
的高氯酸溶液滴定 某弱酸酸式盐
某弱酸酸式盐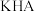 溶液,测得电压变化与滴入
溶液,测得电压变化与滴入 溶液的体积关系如图所示。做空白对照实验,消耗
溶液的体积关系如图所示。做空白对照实验,消耗 溶液的体积为
溶液的体积为 。已知N为滴定终点。下列说法正确的是
。已知N为滴定终点。下列说法正确的是
A.初始时该酸式盐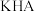 的浓度为 的浓度为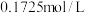 |
B.水的电离程度: |
C.已知 的 的 ,若M点处为中性,则有 ,若M点处为中性,则有 约为0 约为0 |
D.若M点时溶液呈中性,则存在: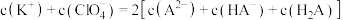 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐1】室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、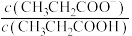 ]的关系如图所示。
]的关系如图所示。
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、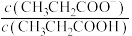 ]的关系如图所示。
]的关系如图所示。
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

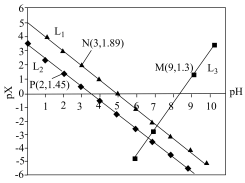
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的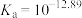 |
C.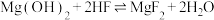 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐2】25℃时, 用0.10mol/L的氨水滴定10.00mL 0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
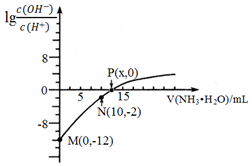
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
| A.H2A为强电解质,是一种强酸 |
| B.M、N、P三点的溶液中,水电离程度最大的是N点 |
C.P点溶液中,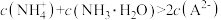 |
| D.25℃时,氨水的电离平衡常数:K=10-7/(0.2x-1) |
您最近一年使用:0次

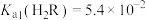 ,
,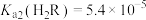 。室温下,下列说法不正确的是
。室温下,下列说法不正确的是 溶液至呈中性时,溶液中
溶液至呈中性时,溶液中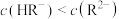
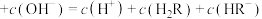
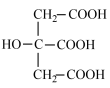 )溶液,溶液中-lgc(H+)与C6H8O7、
)溶液,溶液中-lgc(H+)与C6H8O7、 、
、 、
、 的分布系数δ的关系如图所示[如C6H7O
的分布系数δ的关系如图所示[如C6H7O 的分布系数δ(
的分布系数δ(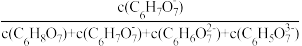 ]。下列说法错误的是
]。下列说法错误的是


