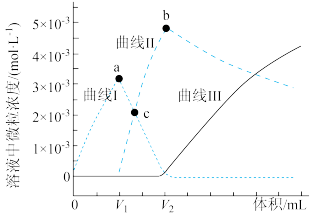
1 .  时,某实验小组利用虚拟感应器技术探究用
时,某实验小组利用虚拟感应器技术探究用 的碳酸钠溶液滴定
的碳酸钠溶液滴定 的
的 溶液,得到反应过程中的碳酸根离子浓度、碳酸氢根离子浓度、碳酸分子浓度的变化曲线(忽略滴定过程中
溶液,得到反应过程中的碳酸根离子浓度、碳酸氢根离子浓度、碳酸分子浓度的变化曲线(忽略滴定过程中 的逸出)如图所示。下列说法正确的是
的逸出)如图所示。下列说法正确的是
已知: 时,
时, 的
的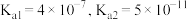 ;
; 。
。
 时,某实验小组利用虚拟感应器技术探究用
时,某实验小组利用虚拟感应器技术探究用 的碳酸钠溶液滴定
的碳酸钠溶液滴定 的
的 溶液,得到反应过程中的碳酸根离子浓度、碳酸氢根离子浓度、碳酸分子浓度的变化曲线(忽略滴定过程中
溶液,得到反应过程中的碳酸根离子浓度、碳酸氢根离子浓度、碳酸分子浓度的变化曲线(忽略滴定过程中 的逸出)如图所示。下列说法正确的是
的逸出)如图所示。下列说法正确的是已知:
 时,
时, 的
的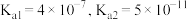 ;
; 。
。
A.碳酸钠的水解常数 |
B.曲线I为 浓度变化曲线, 浓度变化曲线, |
| C.a点和b点溶液中,水的电离程度较大的是a点 |
D.c点溶液 |
您最近一年使用:0次
2023-01-12更新
|
512次组卷
|
3卷引用:湖南省益阳市2022-2023学年高三上学期期末质量检测化学试题
名校
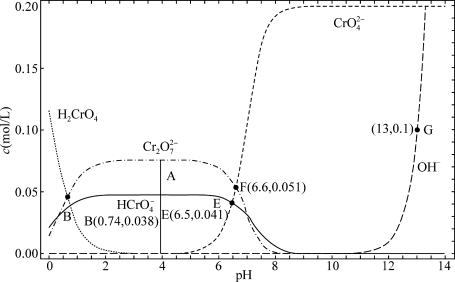
2 . 某温度下,改变0.1mol/L  溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
A.该温度下的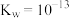 |
B.溶液中存在平衡 ,该温度下此反应的 ,该温度下此反应的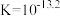 |
C.向0.1mol/L  溶液中加入一定量NaOH固体,溶液橙色变浅 溶液中加入一定量NaOH固体,溶液橙色变浅 |
D.E点溶液中存在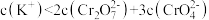 |
您最近一年使用:0次
名校
解题方法
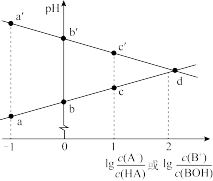
3 . 常温下,浓度相同的一元弱酸 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
A.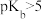 | B.a和a′点的纵坐标之和为14 |
C.水的电离程度: | D.溶液中的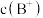 :c点大于c′点 :c点大于c′点 |
您最近一年使用:0次
2022-05-05更新
|
614次组卷
|
3卷引用:湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题
名校
解题方法
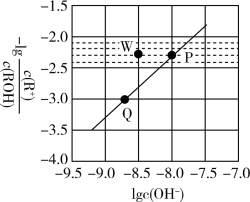
4 . 常温时,将 的
的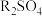 溶液(
溶液(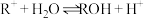 )加水稀释,溶液中
)加水稀释,溶液中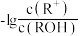 与
与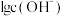 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的
的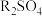 溶液(
溶液(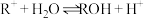 )加水稀释,溶液中
)加水稀释,溶液中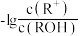 与
与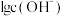 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.常温时, 的电离平衡常数为 的电离平衡常数为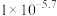 |
B.P、Q点对应的水的电离程度: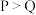 |
C.Q点对应的溶液中, |
D.常温时,加入适量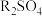 固体可使P点向W点移动 固体可使P点向W点移动 |
您最近一年使用:0次
2022-04-13更新
|
1441次组卷
|
8卷引用:湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题
湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题陕西省榆林市2022届高三第二次联考化学试题河南省大联考2022届高三第三次模拟考试理科综合化学试题(已下线)化学-2022年高考押题预测卷01(全国乙卷)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题甘肃省白银市靖远县2021-2022学年高三下学期开学考试理综化学试题山西省阳泉市2022-2023学年高三上学期期末教学质量监测理科综合化学试题
5 . 室温下,向20.00mL0.10mol·L-1HX溶液中滴加0.10mol·L-1NaOH溶液,溶液pH随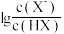 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
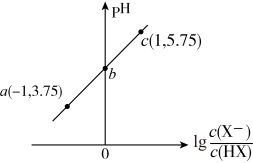
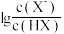 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
| A.室温下,HX的电离平衡常数Ka的数量级为10-5 |
| B.b点时,加入NaOH溶液的体积为10mL |
| C.c点溶液中:c(Na+)=10c(HX) |
| D.溶液中水的电离程度:c>b>a |
您最近一年使用:0次
名校
解题方法
6 . 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
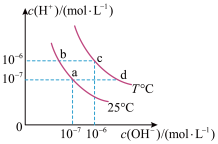

| A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) |
| B.25℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 |
| C.T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显酸性 |
D.b点对应的溶液中大量存在:K+、Ba2+、 、I- 、I- |
您最近一年使用:0次
名校
解题方法
7 . 常温下,磷酸钠溶液中含磷微粒的分布随pH的变化如图所示,M、N、P三点对应的pH分别为a、b、c,其中δ表示含磷微粒的物质的量分数。下列说法错误的是
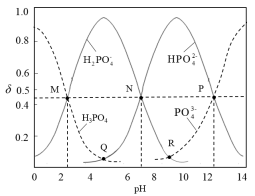

A.常温下, 的一级电离平衡常数Ka1=10-a 的一级电离平衡常数Ka1=10-a |
B.常温下,溶液中水电离出的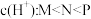 |
C.Q点与R点对应溶液的pH差: |
D.用磷酸标准溶液滴定NaOH溶液,选择酚酞作指示剂,终点时溶质主要为 |
您最近一年使用:0次
2021-02-03更新
|
1090次组卷
|
7卷引用:湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题
湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题河南省新乡市2020-2021学年高二上学期期末考试化学试题湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)
名校
8 . 已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
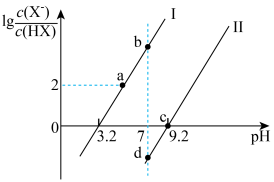
 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
A.直线I对应的是 |
| B.I中a点到b点的过程中水的电离程度逐渐增大 |
C.c点溶液中: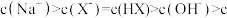  |
| D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+) |
您最近一年使用:0次
2020-04-17更新
|
975次组卷
|
5卷引用:湖南师范大学附属中学2022-2023学年高二上学期第二次大练习化学试题
9 . T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
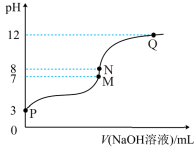
下列说法不正确的是( )

下列说法不正确的是( )
| A..T℃时,HR电离常数Ka≈1.0×10-5 |
| B.M点对应的NaOH溶液体积为20.00mL |
| C.N点与Q点所示溶液中水的电离程度:N>Q |
| D.M点所示溶液中c(Na+)=c(R-) |
您最近一年使用:0次
2020-03-26更新
|
669次组卷
|
6卷引用:湖南省长郡中学2021-2022学年高二上学期期末考试化学试题
10 . 已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=__ 。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__ ,溶液中离子浓度大小关系为__ 。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=__ 。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__ 。(已知lg2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-12-19更新
|
98次组卷
|
2卷引用:湖南省长沙市明达中学2021-2022学年高二上学期12月月考化学试题



