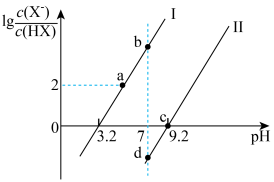
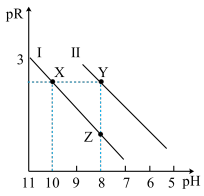
已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
A.直线I对应的是 |
| B.I中a点到b点的过程中水的电离程度逐渐增大 |
C.c点溶液中: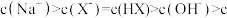  |
| D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+) |
更新时间:2020-04-17 08:54:52
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列有关电离和水解的说法正确的是( )
| A.醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大 |
| B.升温,醋酸钠溶液的水解程度增大,c(OH-)增大,pH也增大 |
| C.等体积等浓度的醋酸和氨水混合后,溶液显中性,则水电离出的c(H+)为10-7 mol/L |
| D.醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COO-)增大,n(H+)减小。 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,下列有关溶液的说法正确的是
| A.往0.3mol/L的NH3·H2O溶液中加入少量NaOH固体,NH3·H2O的电离平衡向逆反应方向移动,同时溶液中。c(NH4+)·c(OH-) /c(NH3·H2O)将减小 |
| B.pH =9的NaOH溶液和NH3·H2O溶液中,由水电离出的c(H+)前者小于后者 |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9) mol/L |
| D.相同条件下,将足量的氢氧化铁固体加入到相同体积的下列溶液:①蒸馏水②0.1mol/L氢氧化钠 ③0.1mol/L氢氧化钡 ④0.1mol/L氯化铁,则铁离子浓度:④>①>②=③ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
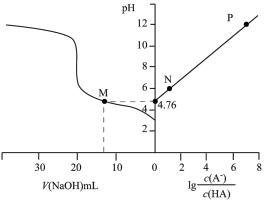
【推荐1】常温下,用 氢氧化钠溶液滴定一定浓度的
氢氧化钠溶液滴定一定浓度的 溶液,溶液的
溶液,溶液的 与加入氢氧化钠溶液的体积
与加入氢氧化钠溶液的体积 、
、 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
 氢氧化钠溶液滴定一定浓度的
氢氧化钠溶液滴定一定浓度的 溶液,溶液的
溶液,溶液的 与加入氢氧化钠溶液的体积
与加入氢氧化钠溶液的体积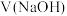 、
、 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
A.从 点到 点到 点,水的电离程度逐渐变大 点,水的电离程度逐渐变大 | B.M点对应的溶液中 |
C.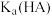 数量级为 数量级为 | D.滴定过程可采用酚酞作为指示剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知电离平衡常数H2SO3:H2SO3⇌HSO +H+ K1=1.54×10-2 ,HSO
+H+ K1=1.54×10-2 ,HSO ⇌SO
⇌SO + H+ K2=1.02×10-7; H2CO3:H2CO3⇌HCO
+ H+ K2=1.02×10-7; H2CO3:H2CO3⇌HCO + H+ K1=4.4×10-7,HCO
+ H+ K1=4.4×10-7,HCO ⇌CO
⇌CO + H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )
+ H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )
 +H+ K1=1.54×10-2 ,HSO
+H+ K1=1.54×10-2 ,HSO ⇌SO
⇌SO + H+ K2=1.02×10-7; H2CO3:H2CO3⇌HCO
+ H+ K2=1.02×10-7; H2CO3:H2CO3⇌HCO + H+ K1=4.4×10-7,HCO
+ H+ K1=4.4×10-7,HCO ⇌CO
⇌CO + H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )
+ H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )A.HSO 、CO 、CO  | B.HSO 、HCO 、HCO  |
C.SO 、HCO 、HCO  | D.SO 、CO 、CO |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,用0.1mol•L-1的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示.AG= ,下列分析不正确的是
,下列分析不正确的是

 ,下列分析不正确的是
,下列分析不正确的是
| A.ROH为弱碱 | B.A点溶液c(Cl−)=c(R+) |
| C.若b=10时,AG<0 | D.若b=15,溶液中存在c(Cl-)+c(OH-)=c(R+)+c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,向 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是

 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是 
A.a点溶液中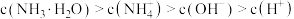 |
| B.b、d两点溶液均呈中性 |
C.c点溶液中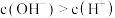 |
D.a、b之间的点可能满足: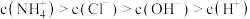 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】下列电解质溶液中有关浓度关系不正确 的是( )
| A.浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-) |
| B.铵根离子浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>② |
| C.常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L |
| D.0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】H2A为二元酸,其电离过程为:H2A H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是

 H++HA-,HA-
H++HA-,HA- H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
H++A2-。常温时,向10mL0.1mol/LH2A水溶液中逐滴滴加0.1mol/LNaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是
A.H2A+A2- 2HA-的K=10-3 2HA-的K=10-3 |
| B.NaHA溶液中水的电离程度大于纯水中水的电离程度 |
| C.NaHA溶液中,c(Na+)>c(HA-)>c(A2-)>c(H2A) |
| D.pH=1.2时,c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】酸性高锰酸钾溶液和草酸反应的化学方程式为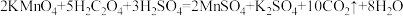 ,图是用
,图是用 标准溶液滴定20 mL用
标准溶液滴定20 mL用 酸化的
酸化的 溶液的数据,其中曲线①为
溶液的数据,其中曲线①为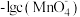 随
随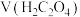 的变化曲线,曲线②为pH随
的变化曲线,曲线②为pH随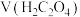 的变化曲线。下列推论错误的是
的变化曲线。下列推论错误的是

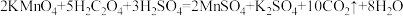 ,图是用
,图是用 标准溶液滴定20 mL用
标准溶液滴定20 mL用 酸化的
酸化的 溶液的数据,其中曲线①为
溶液的数据,其中曲线①为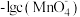 随
随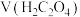 的变化曲线,曲线②为pH随
的变化曲线,曲线②为pH随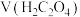 的变化曲线。下列推论错误的是
的变化曲线。下列推论错误的是
A.酸性 溶液中 溶液中 的浓度为0.1mol/L 的浓度为0.1mol/L |
B. 溶液的浓度为 溶液的浓度为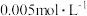 |
C.滴定至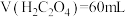 时,反应转移的电子为 时,反应转移的电子为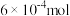 |
| D.高锰酸钾溶液的浓度为0.01mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
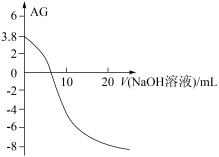
【推荐3】为了更好地表示溶液的酸碱性,科学家提出了酸度的概念: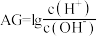 。常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHCN溶液,溶液的酸度AG随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知
。常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHCN溶液,溶液的酸度AG随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知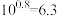 ,下列说法正确的是
,下列说法正确的是
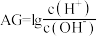 。常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHCN溶液,溶液的酸度AG随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知
。常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHCN溶液,溶液的酸度AG随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知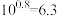 ,下列说法正确的是
,下列说法正确的是
| A.该过程可以用甲基橙作指示剂 |
B.常温下,HCN的电离常数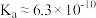 |
C.滴定过程中 的值逐渐减小 的值逐渐减小 |
D.当V=10mL时,溶液中存在: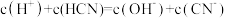 |
您最近一年使用:0次

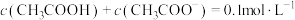 ,
,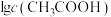 、
、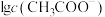 、
、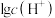 和
和 随
随 为
为 的电离常数,下列说法正确的是
的电离常数,下列说法正确的是
 可知,
可知,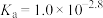
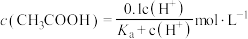
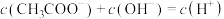
 =100
=100

