名校
解题方法
1 . Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
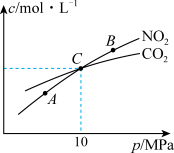
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
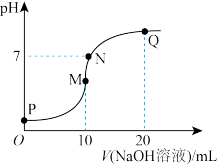
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
 )
)b.N点c(NH
 )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)c.Q点c(NH
 )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
您最近一年使用:0次
名校
解题方法
2 . 常温下,下列各组离子一定能大量共存的是
A.0.1mol•L-1的NaHCO3溶液中:Fe3+、K+、Cl-、 |
B.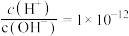 的溶液中:K+、Na+、 的溶液中:K+、Na+、 、 、 |
C.滴加KSCN溶液显红色的溶液中: 、K+、Cl-、I- 、K+、Cl-、I- |
D.水电离产生的c(OH-)=1.0×10-12mol•L-1的溶液中:Na+、Al3+、Cl-、 |
您最近一年使用:0次
2022·重庆·三模
名校
3 . 常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol/LNa2A溶液和40 mL 0.1 mol/L NaHA溶液,再分别用0.2mol/L盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(H2A溶液达到某浓度后,会放出一定量气体)下列说法正确的是(溶液体积变化可忽略)
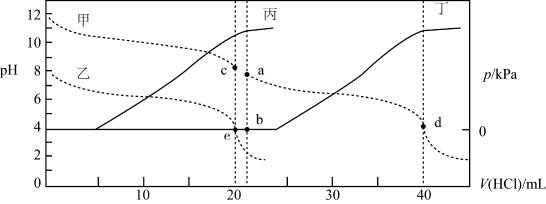

| A.图中曲线乙和丁代表向NaHA溶液中滴加盐酸 |
| B.由图可知,Ka1×Ka2>Kw |
| C.c点pH约为8,且此时溶液中满足:c(Na+)+c(H+)<2c(A2-)+2c(H2A)+c(HA-) |
| D.水的电离程度:b点>d点 |
您最近一年使用:0次
名校
4 . 常温下,用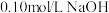 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的
的 溶液和
溶液和 溶液,滴定曲线如图。下列说法正确的是
溶液,滴定曲线如图。下列说法正确的是

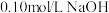 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的
的 溶液和
溶液和 溶液,滴定曲线如图。下列说法正确的是
溶液,滴定曲线如图。下列说法正确的是
A.电离平衡常数: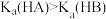 |
| B.水的电离程度:④>①>③>② |
C.点①和点②所示溶液中: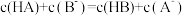 |
D.点③和点④所示溶液中均有: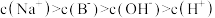 |
您最近一年使用:0次
2021-12-06更新
|
1437次组卷
|
6卷引用:湖北省武汉市武昌区水果湖高级中学2021-2022学年高二上学期12月月考化学试题
5 . 已知:①离子浓度为10-5mol/L时可认为沉淀完全;② 。向
。向 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
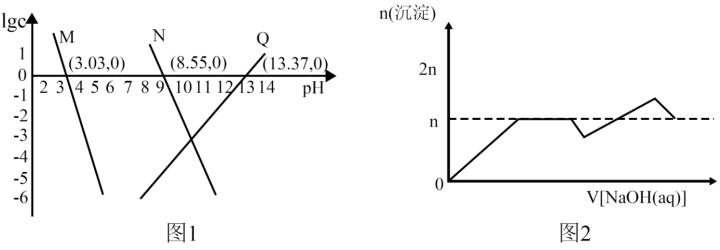
下列说法正确的是:
 。向
。向 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
下列说法正确的是:
| A.图1中M代表Mg2+ |
B. |
| C.[Al(OH)4]-完全沉淀时,溶液pH=6.37 |
| D.该实验中,沉淀的物质的量随NaOH溶液体积变化图象如图2 |
您最近一年使用:0次
2021-10-13更新
|
2307次组卷
|
2卷引用:湖北省武昌实验中学2022届高三十月阶段性测试化学试题
解题方法
6 . 下列说法错误的是
A.叠氮酸( )与 )与 酸性相近,则 酸性相近,则 溶液中离子浓度大小顺序为: 溶液中离子浓度大小顺序为: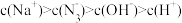 |
B.①100mL0.1mol/L 、②100mL0.1mol/L 、②100mL0.1mol/L 两种溶液中水电离出的 两种溶液中水电离出的 个数:②>① 个数:②>① |
C. 、 、 、 、 、 、 溶于水,对水的电离都有促进作用 溶于水,对水的电离都有促进作用 |
D.室温下,向0.01mol/L 溶液中滴加NaOH溶液至中性: 溶液中滴加NaOH溶液至中性: |
您最近一年使用:0次
名校
解题方法
7 . 常温下,磷酸钠溶液中含磷微粒的分布随pH的变化如图所示,M、N、P三点对应的pH分别为a、b、c,其中δ表示含磷微粒的物质的量分数。下列说法错误的是
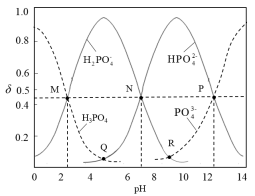

A.常温下, 的一级电离平衡常数Ka1=10-a 的一级电离平衡常数Ka1=10-a |
B.常温下,溶液中水电离出的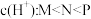 |
C.Q点与R点对应溶液的pH差: |
D.用磷酸标准溶液滴定NaOH溶液,选择酚酞作指示剂,终点时溶质主要为 |
您最近一年使用:0次
2021-02-03更新
|
1088次组卷
|
7卷引用:湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题
湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题河南省新乡市2020-2021学年高二上学期期末考试化学试题(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题
8 . 25℃时,体积均为100mL、浓度均为的两种一元碱MOH和ROH的溶液中,分别通入HCl气体, 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )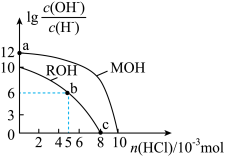
| A.MOH是强碱,ROH是弱碱 |
| B.a点由水电离产生的c(H+)和c(OH-)的乘积为1×10-26 |
| C.b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-) |
| D.c点溶液的pH=7,且所含溶质为ROH和RCl |
您最近一年使用:0次
2020-05-19更新
|
183次组卷
|
5卷引用:【校级联考】湖北省七市州教科研协作体2019届高三下学期三月联合考试理科综合化学试题
【校级联考】湖北省七市州教科研协作体2019届高三下学期三月联合考试理科综合化学试题天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测(已下线)第22讲 水的电离与溶液的pH(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为________ ,则该温度T______ 25(填“>”、“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积变化忽略不计,则a=________ ,实验②中由水电离产生的c(OH-)=______ mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________ (填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________ 。
③按甲方式混合后,所得溶液的pH为__________ 。

(1)此温度下,水的离子积Kw为
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH为
您最近一年使用:0次
2016-12-09更新
|
773次组卷
|
11卷引用:湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题
湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题2015-2016学年河北省邢台一中高二上第一次月考化学试卷2015-2016学年四川省成都市六校高二上学期期中联考化学试卷山东省枣庄市第八中学东校区2020-2021学年高二上学期第二次质量检测化学试题(已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时2 溶液的酸碱性与pH选择性必修1(SJ)专题3第二单元课时1 溶液的酸碱性与pH选择性必修1 专题3 第二单元 课时1 溶液的酸碱性黑龙江省七台河市勃利县高级中学2021-2022学年高二上学期9月月考化学试题山西省怀仁市第一中学2021-2022学年高二上学期期中理科综合化学试题河北省石家庄市部分学校2023-2024学年高二上学期11月联考化学试题



