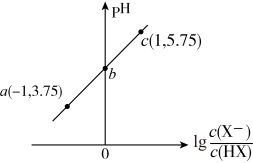
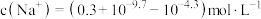室温下,向20.00mL0.10mol·L-1HX溶液中滴加0.10mol·L-1NaOH溶液,溶液pH随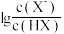 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
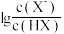 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
| A.室温下,HX的电离平衡常数Ka的数量级为10-5 |
| B.b点时,加入NaOH溶液的体积为10mL |
| C.c点溶液中:c(Na+)=10c(HX) |
| D.溶液中水的电离程度:c>b>a |
更新时间:2022/01/23 19:18:42
|
相似题推荐
多选题
|
较难
(0.4)
【推荐1】常温下,向10mL某浓度的二元弱酸 溶液中滴加
溶液中滴加 NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
 溶液中滴加
溶液中滴加 NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
NaOH溶液,含A微粒的物质的量变化曲线如图所示,下列有关说法不正确的是
A.曲线Ⅱ代表 的物质的量 的物质的量 |
B.水的电离程度大小:a点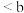 点 点 点 点 |
C. 时,溶液温度最高, 时,溶液温度最高,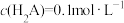 |
D.若c点溶液的 ,则 ,则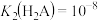 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】某温度下,向Na2C2O4溶液中滴加稀盐酸,所得混合溶液的pH与P[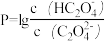 或
或 ]变化关系如图所示:
]变化关系如图所示:
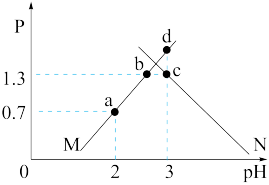
下列说法正确的是
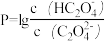 或
或 ]变化关系如图所示:
]变化关系如图所示:
下列说法正确的是
| A.水的电离程度:c>d>b>a |
B.b点时,c(HC2O )>c(HC2O4)>c(H+)>c(C2O )>c(HC2O4)>c(H+)>c(C2O ) ) |
C.c点时,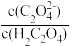 =10-1 =10-1 |
D.d点时,3c(HC2O )>c(Cl-)+c(OH-)-c(H+) )>c(Cl-)+c(OH-)-c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
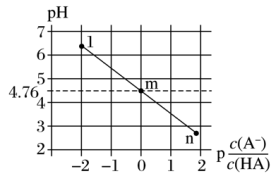
【推荐3】常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:p =-lg
=-lg ]。下列叙述不正确的是
]。下列叙述不正确的是
 =-lg
=-lg ]。下列叙述不正确的是
]。下列叙述不正确的是
| A.m点对应的NaOH溶液体积大于10mL |
| B.Ka(HA)的数量级为10-5 |
| C.1点所示溶液中:c(Na+)<c(A-)+c(HA) |
| D.各点的水溶液中水的电离程度大小关系:n>m>1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】下列说法正确的是
| A.常温下pH=5的盐酸溶液稀释103倍后,pH等于8 |
| B.浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| C.Na2CO3溶液中存在:2c(Na+) =c(CO32-) +c(HCO3-)+c(H2CO3) |
| D.常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合:c(K+) +c(H+) =c(OH-) +c(CH3COO-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
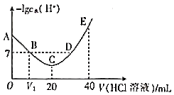
【推荐2】羟胺的电离方程式: (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
 (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
A.图中 |
B.A点对应溶液的 |
| C.B、D两点对应的溶液的pH相等 |
D.C点对应溶液中存在: |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】常温下,已知Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是
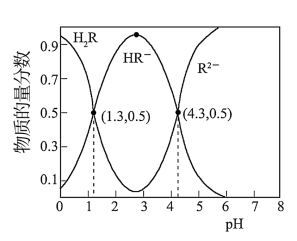

| A.H2R的二级电离常数Ka2的数量级为10-5 |
| B.在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) |
| C.等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) |
D.向Na2CO3溶液中加入过量H2R溶液,发生的反应是:CO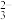 +H2R=CO2↑+H2O+R2- +H2R=CO2↑+H2O+R2- |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温时,向 100mL 0.1mol·L-1 NH4HSO4溶液中滴加 0.1mol·L-1NaOH 溶液,溶液 pH随 NaOH 溶液体积的变化如图所示。下列说法正确的是
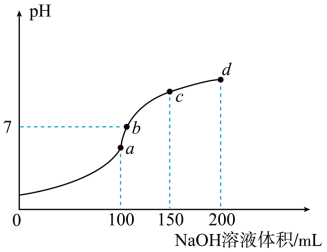

| A.图中 a、b、c、d 四个点,水的电离程度最大的是 d 点 |
B.a 点处存在 c(NH )+c(NH3·H2O)=0.1mol·L-1 )+c(NH3·H2O)=0.1mol·L-1 |
C.b 点处存在 c(Na+)>c(SO )>c(NH )>c(NH )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
| D.由 b 到 c 发生反应的离子方程式为 NH4++OH-=NH3·H2O |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐2】室温下,向10mL浓度均为0.1mol/L的CuCl2、FeCl2和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-lgc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)<Ksp(ZnS),Ksp(FeS)=6.25×10-18,lg25=1.4。下列说法正确的是
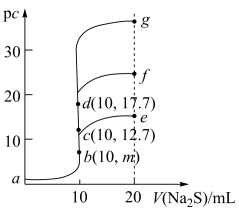

| A.m=8.6 |
| B.a点的CuCl2溶液中:2c(Cu2+)>c(Cl−)+c(OH−) |
| C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程 |
| D.将足量晶体ZnCl2加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10−24.4mol·L−1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
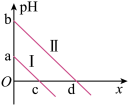
【推荐3】邻苯二甲酸(H2M)的pKa1=2.95,pKa2=5.41(已知pK= -lg K)。室温下,向一定浓度的H2M溶液中滴加0.1 mol·L-1NaOH溶液,混合溶液中x与pH的关系如图所示。其中x=lg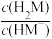 或lg
或lg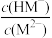 ,下列说法错误的是
,下列说法错误的是
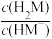 或lg
或lg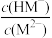 ,下列说法错误的是
,下列说法错误的是
| A.直线II上的所有点对应溶液中水的电离程度大于直线I |
| B.c(Na+ )=c(HM- ) +c(M2- )时,pH<7 |
| C.a=c=2.95,b=d=5.41 |
| D.溶液中c(M2- )>c(HM- )时,pH≥7 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】用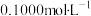 盐酸滴定
盐酸滴定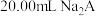 溶液,溶液中
溶液,溶液中 、
、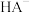 、
、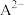 的分布分数δ随
的分布分数δ随 变化曲线及滴定曲线如图。下列说法正确的是
变化曲线及滴定曲线如图。下列说法正确的是
[如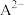 分布分数:
分布分数: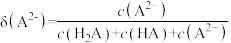
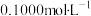 盐酸滴定
盐酸滴定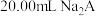 溶液,溶液中
溶液,溶液中 、
、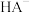 、
、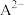 的分布分数δ随
的分布分数δ随 变化曲线及滴定曲线如图。下列说法正确的是
变化曲线及滴定曲线如图。下列说法正确的是[如
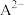 分布分数:
分布分数: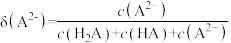

A. 的 的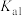 为 为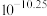 | B.c点: |
| C.第一次突变,可选酚酞作指示剂 | D.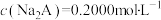 |
您最近一年使用:0次
多选题
|
较难
(0.4)
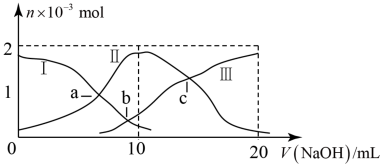
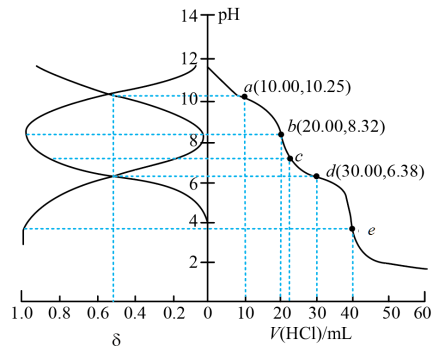
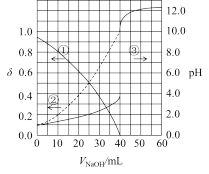
【推荐2】以酚酞为指示剂,用0.1000mol/L的NaOH溶液滴定20mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,[比如A2-的分布系数:δ(A2-)= ],下列叙述错误的是
],下列叙述错误的是
 ],下列叙述错误的是
],下列叙述错误的是
| A.HA-的电离常数Ka=1.0×10-5 | B.曲线①代表δ(H2A),曲线②代表δ(HA-) |
| C.H2A溶液的浓度为0.1000mol/L | D.由图可知H2A的第一步电离方程式为H2A=HA-+H+ |
您最近一年使用:0次

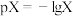 [
[ 为
为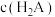
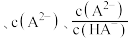 ]。下列说法正确的是
]。下列说法正确的是
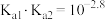
 时,
时,