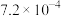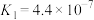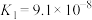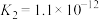物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
I.常温下,一定浓度的 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数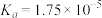 。
。
(1)乙酸钠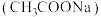 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。 的
的 溶液中:
溶液中: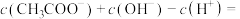
_______  。
。
Ⅱ.常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。

(2)在常温下 的电离平衡常数
的电离平衡常数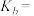
_______ (用含有a的代数式表示)。
Ⅲ. 时,向
时,向 溶液中滴加
溶液中滴加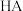 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:

(3)根据该图判断HA为_______ (填“强酸”或“弱酸”),理由是_______ 。
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会_______ (填“增大”、“减小”或“不变”)。
(5)d点溶液中溶质成分是_______ ,溶液中离子浓度大小关系_______ 。
I.常温下,一定浓度的
 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数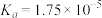 。
。(1)乙酸钠
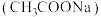 溶液呈碱性的原因是
溶液呈碱性的原因是 的
的 溶液中:
溶液中: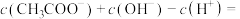
 。
。Ⅱ.常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。
(2)在常温下
 的电离平衡常数
的电离平衡常数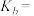
Ⅲ.
 时,向
时,向 溶液中滴加
溶液中滴加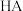 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:
(3)根据该图判断HA为
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会
(5)d点溶液中溶质成分是
更新时间:2024-01-22 08:45:22
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
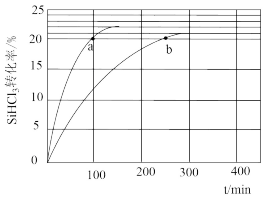
①343 K时反应的平衡转化率α=________ %。平衡常数K343 K=________ (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________ ;要缩短反应达到平衡的时间,可采取的措施有________ 、________ 。
③比较a、b处反应速率大小:va________ vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________ (保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
①请用文字解释随温度升高水的离子积增大的原因 _______________ ;
②10℃时纯水的电离平衡常数为_________ ;计算100℃时纯水中电离产生的氢离子浓度为__________________ 。

①343 K时反应的平衡转化率α=
②在343 K下:要提高SiHCl3转化率,可采取的措施是
③比较a、b处反应速率大小:va
(2)不同温度下水的离子积常数如表所示:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
②10℃时纯水的电离平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】完成下列问题
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量_______ 1molSO2 (g)的能量。
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)_______ 乙溶液中的c(OH—),甲溶液中水电离出的c(OH—)_______ 乙溶液中水电离出的c(OH—)。
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a_______ b。
(2)在一定条件下,醋酸溶液中存在电离平衡: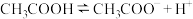 ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是_______ 。
a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
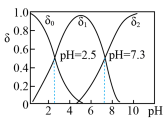
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO: ,
, :
: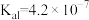 ,
,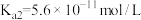 ;
; :
: ,
,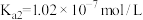 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)_______ 。
(4)某温度下纯水中的c(H+)=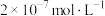 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)=_______ ;若温度不变,滴入稀盐酸,使c(H+)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=_______ 。
(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
① 爆炸:
爆炸: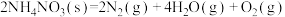
_______
②水煤气转化: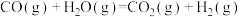
_______
③臭氧的生成: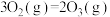
_______
A.熵增大 B.熵减小 C.熵变很小
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a
(2)在一定条件下,醋酸溶液中存在电离平衡:
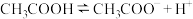 ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO:
 ,
, :
: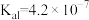 ,
,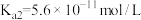 ;
; :
: ,
,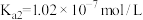 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)(4)某温度下纯水中的c(H+)=
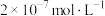 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
①
 爆炸:
爆炸: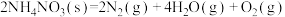
②水煤气转化:
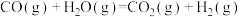
③臭氧的生成:
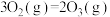
A.熵增大 B.熵减小 C.熵变很小
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO .
.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________ (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________ (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH )
)______________ c(SO )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH______________ 7(填“>”、”=”或“<”)。
(3)将分别含有MnO 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________ ,一定不存在的是______________ 。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为________________ mol·L−1,此时溶液中c(CrO )等于
)等于______________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO
 .
. (1)常温下,pH=5的NaHSO4溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:
 )
) )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH(3)将分别含有MnO
 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
 )等于
)等于
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】已知:
(1)浓度均为 的下列四种溶液,
的下列四种溶液, 由小到大排列的顺序是
由小到大排列的顺序是________ 。
A. B.
B. C.
C. D.
D.
(2)①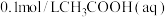 加水稀释过程中,下列数据变大的是
加水稀释过程中,下列数据变大的是________ (选填编号)。
A. B.
B. C.
C.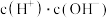 D.
D. E.
E.
②将 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,稀释后
,稀释后 ;醋酸
;醋酸______ 盐酸(选填编号,下同)。稀释后溶液中水的电离程度:醋酸_____ 盐酸。
A. B.
B. C.
C.
③ 时,将
时,将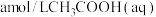 与
与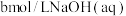 等体积混合,反应后溶液恰好显中性,用含
等体积混合,反应后溶液恰好显中性,用含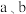 的代数式表示
的代数式表示 的电离平衡常数
的电离平衡常数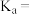
________ 。
④向 浓度均为
浓度均为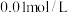 的
的 和
和 的混合液中加入等体积
的混合液中加入等体积 的
的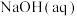 ,充分反应,混合液中离子浓度由大到小的顺序为
,充分反应,混合液中离子浓度由大到小的顺序为________ 。
(3)①将少量 通入
通入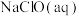 发生反应的离子方程式为
发生反应的离子方程式为________ 。
②将 通入该氨水中,当溶液中
通入该氨水中,当溶液中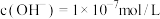 时,则溶液中
时,则溶液中
________  (选填编号)。
(选填编号)。
A. B.
B. C.
C.
 |  |  |  |  |
| 电离平衡常数 | 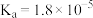 | 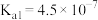 , ,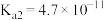 | 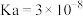 | 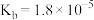 |
 的下列四种溶液,
的下列四种溶液, 由小到大排列的顺序是
由小到大排列的顺序是A.
 B.
B. C.
C. D.
D.
(2)①
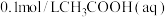 加水稀释过程中,下列数据变大的是
加水稀释过程中,下列数据变大的是A.
 B.
B. C.
C.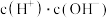 D.
D. E.
E.
②将
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,稀释后
,稀释后 ;醋酸
;醋酸A.
 B.
B. C.
C.
③
 时,将
时,将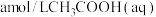 与
与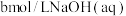 等体积混合,反应后溶液恰好显中性,用含
等体积混合,反应后溶液恰好显中性,用含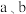 的代数式表示
的代数式表示 的电离平衡常数
的电离平衡常数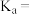
④向
 浓度均为
浓度均为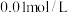 的
的 和
和 的混合液中加入等体积
的混合液中加入等体积 的
的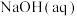 ,充分反应,混合液中离子浓度由大到小的顺序为
,充分反应,混合液中离子浓度由大到小的顺序为(3)①将少量
 通入
通入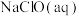 发生反应的离子方程式为
发生反应的离子方程式为②将
 通入该氨水中,当溶液中
通入该氨水中,当溶液中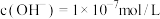 时,则溶液中
时,则溶液中
 (选填编号)。
(选填编号)。A.
 B.
B. C.
C.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】(一)完成下列问题
(1)在2L密闭容器中进行如下反应: ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是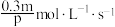 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______
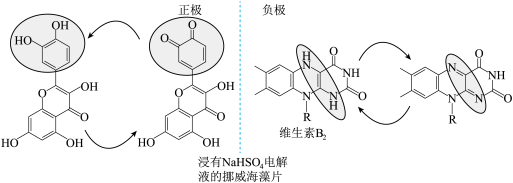
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[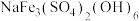 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由___________
___________
(4)以酚酞为指示剂,用0.1000 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
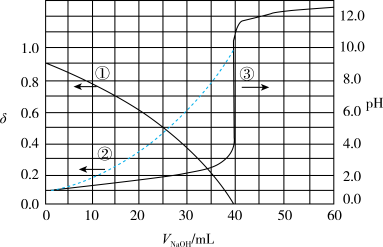
[比如 的分布系数:
的分布系数: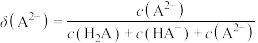 ]知:常温下
]知:常温下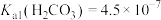 ,
,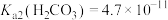 。
。
下列叙述正确的是______
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼( )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓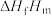 如下表所示。
如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用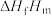 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: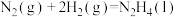
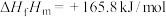
①
___________ kJ/mol。
②结合化学反应原理分析, (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是___________
___________ 。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
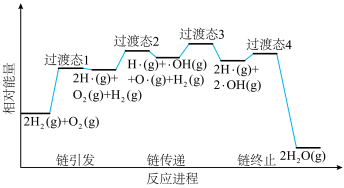
该历程分___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
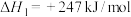
b:
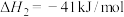
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力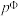 (
(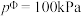 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
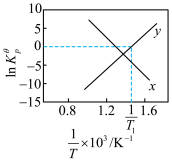
(7)①能表示反应b的曲线为___________ ,反应a的标准压强平衡常数表达式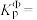
___________ 。
②维持 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为___________ , 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)___________ kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
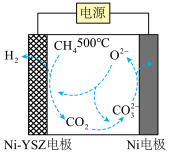
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
(1)在2L密闭容器中进行如下反应:
 ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是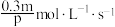 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______A.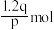 | B. | C.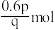 | D.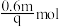 |
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素
 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
A.放电过程中海藻片中 向维生素 向维生素 电极迁移 电极迁移 |
B.放电时负极反应: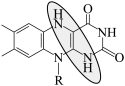 -2e- -2e-  +2H+ +2H+ |
C.充电时总反应: + + → → + + |
| D.该电池即使儿童误食也不会导致体内水电解而损害身体 |
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[
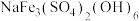 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由(4)以酚酞为指示剂,用0.1000
 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
[比如
 的分布系数:
的分布系数: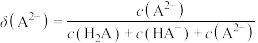 ]知:常温下
]知:常温下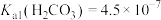 ,
,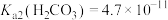 。
。下列叙述正确的是______
A.曲线①代表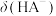 , ,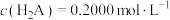 |
B.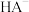 的电离常数 的电离常数 |
C.滴定过程,pH=2时溶液中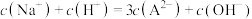 |
D.向 溶液中加入少量 溶液中加入少量 溶液,发生离子反应: 溶液,发生离子反应: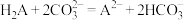 |
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(
 )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:(5)火箭推进剂可用
 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓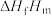 如下表所示。
如下表所示。| 物质 |  (g) (g) |  (l) (l) |  (g) (g) |
摩尔生成焓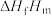 (kJ/mol) (kJ/mol) | +10.8 | +165.8 | -242.0 |
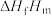 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: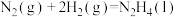
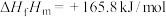
①

②结合化学反应原理分析,
 (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:

b:

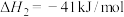
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力
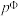 (
(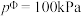 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
(7)①能表示反应b的曲线为
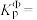
②维持
 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:

您最近一年使用:0次
【推荐3】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断试样的pH=_________ 。
(2)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是
2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:_______________ 。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
①写出NO与活性炭反应的化学方程式______________________ ;
②计算上述反应T1℃时的平衡常数K1=______________ ;
若T1<T2,则该反应的△H__________ 0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________ ;
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- | |
| 度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 | |
根据表中数据判断试样的pH=
(2)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是
2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化 B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式
②计算上述反应T1℃时的平衡常数K1=
若T1<T2,则该反应的△H
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:
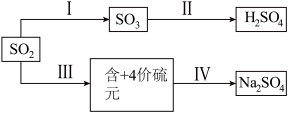
(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____ 。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____ 。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____ 。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____ (填字母)。
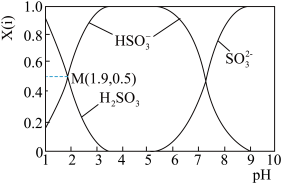
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c( )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)
C.由 M 点坐标,可以计算H2SO3⇌H++ 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c( )+2c(
)+2c( )+c(OH-)
)+c(OH-)
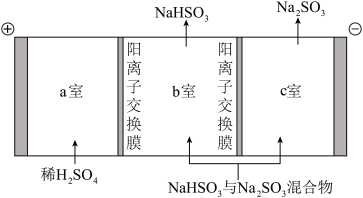
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____ 。
(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____ ,_____ (任意写两种)。

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程
 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(
 )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)C.由 M 点坐标,可以计算H2SO3⇌H++
 的电离常数
的电离常数D.pH=9 时,溶液中存在c(H+)=c(
 )+2c(
)+2c( )+c(OH-)
)+c(OH-)(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】已知草酸为二元弱酸:H2C2O4
 +H+ , Ka1,
+H+ , Ka1,

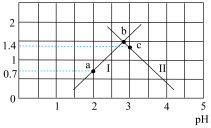
 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中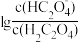 或
或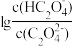 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=__________ ,Ka2=__________ 。
(2)如果所得溶液溶质为KHC2O4,则该溶液显________ (填“酸性”“碱性”或“中性”)。
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为__________ 。
(4)a、b、c三点,水的电离程度的变化趋势是___________ 。
(5)已知电离度 ,
,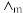 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,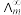 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 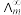 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的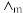 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。
①该条件下测定的0.01mol/L乙酸中的c(H+)为_________ mol/L。
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐_______ (填化学式)。

 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中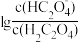 或
或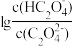 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=
(2)如果所得溶液溶质为KHC2O4,则该溶液显
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为
(4)a、b、c三点,水的电离程度的变化趋势是
(5)已知电离度
 ,
,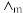 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,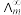 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 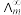 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的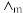 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。①该条件下测定的0.01mol/L乙酸中的c(H+)为
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐
| 离子种类 |  | Cl- | CH3COO- | K+ | Na+ |
| 摩尔电导率/(10-4 S·m2·mol-1) . | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】请应用化学反应原理的相关知识解决下列问题:
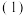 已知NaCl的溶解热为
已知NaCl的溶解热为 吸热
吸热
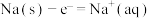
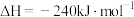
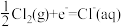
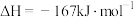
写出钠在氯气中燃烧的热化学方程式:__________ 。
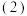 一定条件下,在
一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入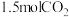 和
和 发生反应:
发生反应: ,如图所示为反应体系中
,如图所示为反应体系中 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为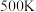 的条件下,该反应
的条件下,该反应 达到平衡状态;
达到平衡状态;
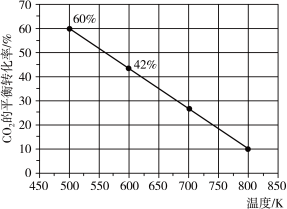
 该反应是
该反应是________  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
 在
在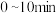 时段反应速率
时段反应速率 为
为_________ 。
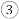 若改充入
若改充入 和
和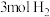 ,图中的曲线会
,图中的曲线会_________  填“上移”或“下移”
填“上移”或“下移” 。
。
 根据下表数据回答问题:
根据下表数据回答问题:
表1 时浓度为
时浓度为 两种溶液的pH
两种溶液的pH
表2 时两种酸的电离平衡常数
时两种酸的电离平衡常数
 根据表1能不能判断出
根据表1能不能判断出 与HClO酸性强弱?
与HClO酸性强弱?_____________  填“能”或“不能”
填“能”或“不能” 。
。
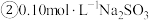 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为__________ 。
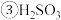 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为________ 。
 已知:
已知: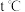 时,
时, 、
、 ;AgCl为白色沉淀,
;AgCl为白色沉淀, 为砖红色沉淀。
为砖红色沉淀。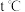 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为__________ 。
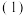 已知NaCl的溶解热为
已知NaCl的溶解热为 吸热
吸热
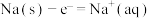
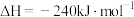
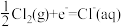
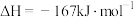
写出钠在氯气中燃烧的热化学方程式:
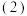 一定条件下,在
一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入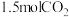 和
和 发生反应:
发生反应: ,如图所示为反应体系中
,如图所示为反应体系中 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为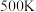 的条件下,该反应
的条件下,该反应 达到平衡状态;
达到平衡状态;
 该反应是
该反应是 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。 在
在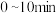 时段反应速率
时段反应速率 为
为 若改充入
若改充入 和
和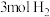 ,图中的曲线会
,图中的曲线会 填“上移”或“下移”
填“上移”或“下移” 。
。 根据下表数据回答问题:
根据下表数据回答问题:表1
 时浓度为
时浓度为 两种溶液的pH
两种溶液的pH| 溶质 | NaClO |  |
| pH | 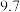 |  |
表2
 时两种酸的电离平衡常数
时两种酸的电离平衡常数 |  | |
 | 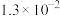 | 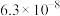 |
 | 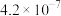 | 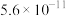 |
 根据表1能不能判断出
根据表1能不能判断出 与HClO酸性强弱?
与HClO酸性强弱? 填“能”或“不能”
填“能”或“不能” 。
。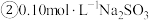 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为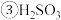 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为 已知:
已知: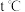 时,
时, 、
、 ;AgCl为白色沉淀,
;AgCl为白色沉淀, 为砖红色沉淀。
为砖红色沉淀。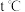 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】通过对阳极泥的综合处理可以回收贵重金属,一种从铜阳极泥(主要成分为Se、Ag、Ag2Se、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
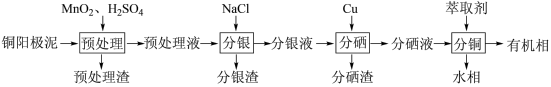
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为_______ 。
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是_______ 。
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:_______ 。
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++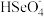 ,
,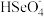
 H++
H++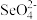 ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(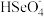 )=
)=_______ (写出含x的计算式)。
(5)分铜得到产品CuSO4·5H2O的具体操作如图:
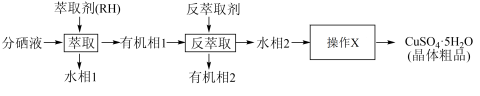
①萃取的原理为:2RH+Cu2+ R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用_______ (填化学式)溶液。
②操作X为_______ ,过滤;
③为了减少CuSO4·5H2O的损失,最好选用_______ 进行洗涤。
A.冷水 B.热水 C.无水乙醇
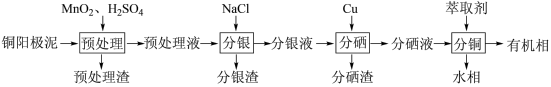
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++
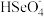 ,
,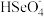
 H++
H++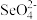 ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(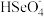 )=
)=(5)分铜得到产品CuSO4·5H2O的具体操作如图:

①萃取的原理为:2RH+Cu2+
 R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用②操作X为
③为了减少CuSO4·5H2O的损失,最好选用
A.冷水 B.热水 C.无水乙醇
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题:
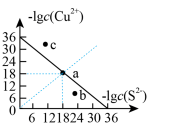
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下 饱和溶液中,
饱和溶液中,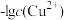 和
和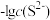 关系如图所示,
关系如图所示,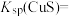
___________ ;图中a、b、c三点对应的溶液中,一定存在 沉淀的是
沉淀的是___________ (填序号)。
(2)工业上常用连二亚硫酸钠 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为___________ 。吸收塔内每吸收 的
的 ,理论上
,理论上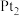 电极上会放出
电极上会放出___________ 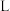 气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(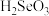 )和硒酸(
)和硒酸(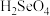 ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸(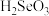 )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
①将 滴入
滴入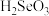 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是___________ 。
②25℃时,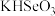 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:___________ 。
③已知硒酸的电离方程式为: ,
, 。25℃时,下列关于
。25℃时,下列关于
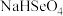 溶液的说法错误的是
溶液的说法错误的是___________ 。
A.
B.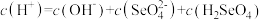
C.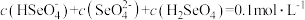
D.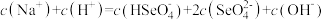
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下
 饱和溶液中,
饱和溶液中,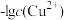 和
和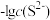 关系如图所示,
关系如图所示,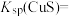
 沉淀的是
沉淀的是
(2)工业上常用连二亚硫酸钠
 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为 的
的 ,理论上
,理论上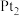 电极上会放出
电极上会放出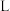 气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(
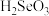 )和硒酸(
)和硒酸(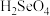 ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸(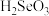 )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
①将
 滴入
滴入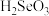 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是②25℃时,
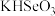 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:③已知硒酸的电离方程式为:
 ,
, 。25℃时,下列关于
。25℃时,下列关于
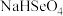 溶液的说法错误的是
溶液的说法错误的是A.

B.
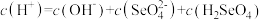
C.
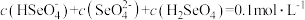
D.
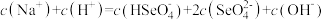
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,物质的量浓度相同的三种溶液NaF、 、
、 ,pH最大的是
,pH最大的是________ 。
②将过量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是________ 。
(2)二元弱酸 溶液中
溶液中 、
、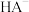 、
、 的物质的量分数
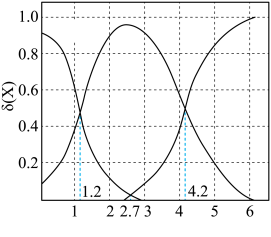
的物质的量分数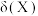 随pH的变化如图所示,则
随pH的变化如图所示,则 的电离平衡常数
的电离平衡常数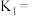
________ 。
(3)向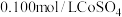 溶液中滴加NaOH溶液调节pH,
溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现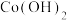 沉淀,继续滴加NaOH溶液至
沉淀,继续滴加NaOH溶液至
________ 时, 沉淀完全
沉淀完全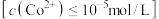 。
。
(4)已知: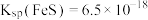 ,
,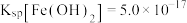 ,
, 的电离常数分别为
的电离常数分别为 、
、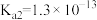 ,在酸性溶液中,反应
,在酸性溶液中,反应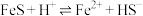 的平衡常数K的数值为
的平衡常数K的数值为________ 。
(5)某工业酸性废水中含有一定量的氨氮以 形式存在,向酸性废水中加入适量
形式存在,向酸性废水中加入适量 溶液,则氨氮转化为
溶液,则氨氮转化为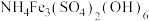 沉淀,处理后可使水中氨氮达到国家规定的排放标准。
沉淀,处理后可使水中氨氮达到国家规定的排放标准。
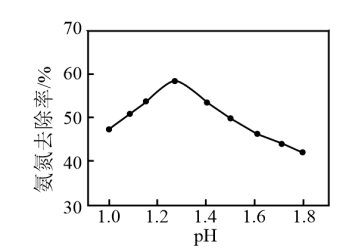
①该反应的离子方程式:________ 。
②废水中氨氮去除率随pH的变化如图所示,当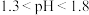 时,氨氮去除率随pH升高而降低的原因是
时,氨氮去除率随pH升高而降低的原因是________ 。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF |
|
|
电离平衡常数K25℃ |
|
|
|
 、
、 ,pH最大的是
,pH最大的是②将过量
 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是(2)二元弱酸
 溶液中
溶液中 、
、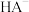 、
、 的物质的量分数
的物质的量分数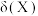 随pH的变化如图所示,则
随pH的变化如图所示,则 的电离平衡常数
的电离平衡常数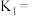

(3)向
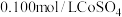 溶液中滴加NaOH溶液调节pH,
溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现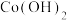 沉淀,继续滴加NaOH溶液至
沉淀,继续滴加NaOH溶液至
 沉淀完全
沉淀完全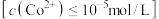 。
。(4)已知:
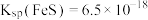 ,
,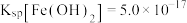 ,
, 的电离常数分别为
的电离常数分别为 、
、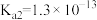 ,在酸性溶液中,反应
,在酸性溶液中,反应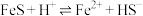 的平衡常数K的数值为
的平衡常数K的数值为(5)某工业酸性废水中含有一定量的氨氮以
 形式存在,向酸性废水中加入适量
形式存在,向酸性废水中加入适量 溶液,则氨氮转化为
溶液,则氨氮转化为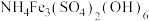 沉淀,处理后可使水中氨氮达到国家规定的排放标准。
沉淀,处理后可使水中氨氮达到国家规定的排放标准。
①该反应的离子方程式:
②废水中氨氮去除率随pH的变化如图所示,当
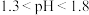 时,氨氮去除率随pH升高而降低的原因是
时,氨氮去除率随pH升高而降低的原因是
您最近一年使用:0次