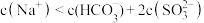某二元酸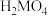 在水中分两步电离:
在水中分两步电离: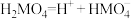 ,
, 。常温下,向20 mL
。常温下,向20 mL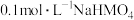 溶液中滴入
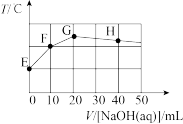
溶液中滴入 溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
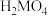 在水中分两步电离:
在水中分两步电离: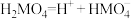 ,
, 。常温下,向20 mL
。常温下,向20 mL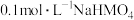 溶液中滴入
溶液中滴入 溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
| A.该NaOH溶液pH=13 |
| B.从G点到H点水的电离平衡正向移动 |
C.图象中E点对应的溶液中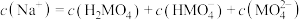 |
D.若F点对应的溶液pH=2,则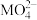 的水解平衡常数约为 的水解平衡常数约为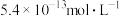 |
21-22高三上·山东烟台·期末 查看更多[6]
山东省烟台市2021届高三上学期期末考试化学试题安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题
更新时间:2021-01-23 10:49:37
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】设NA为阿伏加德罗常数的值,下列说法正确的
| A.一定量的Na2O2溶于足量水,生成1.6gO2时转移电子的数目为0.2NA |
| B.在1.8gH2O与2.24LO2中含有的分子数相同,均为0.1NA |
| C.在1mol由C2H4和C3H6的混合物中,含C-H键的数目一定为5NA |
| D.在常温下,1LpH=10的Na2CO3溶液中含H+的数目一定为10-10NA |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】室温下,向10mL HA溶液中滴加
HA溶液中滴加 的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:
的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知: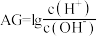 。
。

下列说法错误的是
 HA溶液中滴加
HA溶液中滴加 的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:
的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知: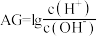 。
。
下列说法错误的是
| A.在a、b、c、d点对应的溶液中,c点时水的电离程度最大 |
B.b点对应的溶液中: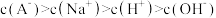 |
C.d点对应的溶液中: |
D.室温下,HA的电离常数 约为1.0 约为1.0 10-4 10-4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】常温下,用0.1mol·L-1盐酸滴定25mL 0.1mol·L-1BOH溶液的过程中,溶液pH的变化曲线如图1所示,用0.1mol·L-1NaOH溶液滴定25mL0.1mol·L-1HA溶液的过程中溶液pH的变化曲线如图2所示(忽略溶液体积变化)。下列说法不正确的是


| A.常温下,若用等浓度的HA溶液滴定该BOH溶液,所得到的图象与图1相同 |
| B.若将c点所示溶液与e点所示溶液混合,混合后溶液中存在c(H+)=c(OH-)+c(BOH) |
| C.V1<25,且b、d点所示溶液中,水的电离程度为b>d |
| D.a点所示溶液中粒子浓度大小关系:c(OH-)>c(BOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,RNH2+H2O⇌OH-+ 的平衡常数K=4×10-4,在某体系中,
的平衡常数K=4×10-4,在某体系中, 与OH-等离子不能穿过隔膜,RNH2可自由穿过该膜。设溶液中的c(R)=c(RNH2)+c(
与OH-等离子不能穿过隔膜,RNH2可自由穿过该膜。设溶液中的c(R)=c(RNH2)+c( ),当达到平衡时,两侧溶液的pH如图所示。
),当达到平衡时,两侧溶液的pH如图所示。
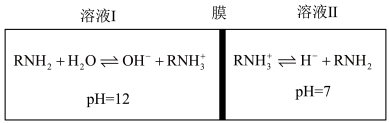
下列叙述错误的是
 的平衡常数K=4×10-4,在某体系中,
的平衡常数K=4×10-4,在某体系中, 与OH-等离子不能穿过隔膜,RNH2可自由穿过该膜。设溶液中的c(R)=c(RNH2)+c(
与OH-等离子不能穿过隔膜,RNH2可自由穿过该膜。设溶液中的c(R)=c(RNH2)+c( ),当达到平衡时,两侧溶液的pH如图所示。
),当达到平衡时,两侧溶液的pH如图所示。
下列叙述错误的是
| A.溶液I、II中的c(RNH2)相等 |
B.溶液II中c(H+)=c(OH-)-c( ) ) |
C.溶液I中c(RNH2):c( )=25:1 )=25:1 |
D.溶液I中c( )小于溶液II中c( )小于溶液II中c( ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下将NaOH溶液滴加到亚硒酸( H2SeO3)溶液中 ,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
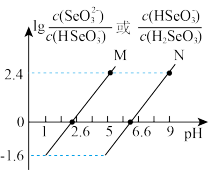

A.曲线M表示pH与lg |
| B.Ka2(H2SeO3)的数量级为10-7 |
C.混合溶液中 =104 =104 |
D.NaHSeO3溶液中c( H2SeO3)>c( ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,用0.2 mol/LNaOH溶液分别滴定相同浓度的一元酸HX溶液和HY溶液,滴定过程中溶液的pH变化关系如图所示。下列说法正确的是


| A.等物质的量浓度的NaX、NaY的溶液,NaY溶液碱性较强 |
| B.pH与体积均相等的HX、HY中和NaOH的能力:HX>HY |
| C.常温下K(X)的数量级为10-9 |
| D.将b点溶液加水稀释10倍可得到c点对应的溶液 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】将 氨水滴入
氨水滴入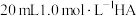 溶液中,溶液中水电离出的
溶液中,溶液中水电离出的 和混合液温度(T)随加入氨水体积变化曲线如图所示。
和混合液温度(T)随加入氨水体积变化曲线如图所示。
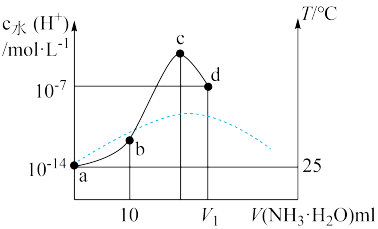
下列有关说法错误的是
 氨水滴入
氨水滴入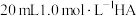 溶液中,溶液中水电离出的
溶液中,溶液中水电离出的 和混合液温度(T)随加入氨水体积变化曲线如图所示。
和混合液温度(T)随加入氨水体积变化曲线如图所示。
下列有关说法错误的是
| A.NH4A溶液呈酸性 |
B.b点溶液: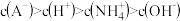 |
C.c点溶液: |
D.25℃时, 水解平衡常数为 水解平衡常数为 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L−1,下列说法错误的是
| A.Na2CO3溶液加水稀释后,溶液中c(HCO3−)/c(CO32−)的值增大 |
| B.将③、④等体积混合所得溶液中:2c(OH−)−2c(H+)=3c(H2CO3)+2c(HCO3−)−c(CO32−) |
| C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<② |
| D.将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+)>c(NH3·H2O) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】Ga与Al同为第IIIA族元素,常温下,向NaGa(OH)4溶液中滴加醋酸溶液,溶液中Ga3+及其与OH-形成的微粒的浓度分数α随溶液pH变化的关系如图所示。已知CH3COOH的电离平衡常数Ka=1.8×10-5,关于该过程的说法正确的是
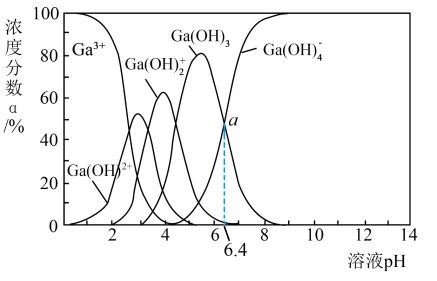

| A.Ga(OH)4的浓度分数先减小后增大 |
B.Ga3++H2O Ga(OH)2++H+,该平衡常数K的数量级为10-2 Ga(OH)2++H+,该平衡常数K的数量级为10-2 |
C.若a点时c[Ga(OH) ]=1mol/L,Ga(OH) ]=1mol/L,Ga(OH) (aq)+CH3COOH(aq) (aq)+CH3COOH(aq) Ga(OH)3(s)+H2O(l)+CH3COO-(aq)的平衡常数K=1.8×101.4 Ga(OH)3(s)+H2O(l)+CH3COO-(aq)的平衡常数K=1.8×101.4 |
D.pH=7时c(Na+)+3c(Ga3+)+2c(Ga(OH)2+)+c(Ga(OH) )=c[Ga(OH) )=c[Ga(OH) ] ] |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,现有0.1mol•L-1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
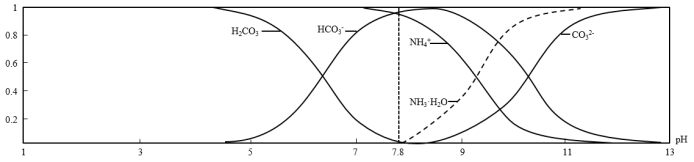
下列说法不正确的是

下列说法不正确的是
| A.分析可知,常温下Kb(NH3•H2O)>Ka1(H2CO3) |
B.0.1 mol•L-1 NH4HCO3溶液中存在:c(NH3•H2O)=c(H2CO3)+c(CO ) ) |
C.当溶液的pH=9时,溶液中存在:c(HCO )>c(NH )>c(NH )>c(NH3•H2O)>c(CO )>c(NH3•H2O)>c(CO ) ) |
D.向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH 和HCO 和HCO 浓度逐渐减小 浓度逐渐减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。

下列说法错误的是

下列说法错误的是
| A.H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38 |
| B.pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-) |
C.25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79 HCO3-+OH-的平衡常数对数值1gK=-3.79 |
| D.pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-) |
您最近一年使用:0次

 和
和 ,从而实现变废为宝,工作原理如图。下列说法正确的是
,从而实现变废为宝,工作原理如图。下列说法正确的是
 减小
减小