名校
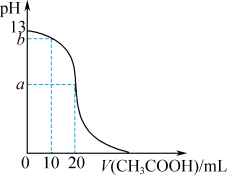
1 . 常温下,量取10.00mL 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
A. 溶液的浓度为 溶液的浓度为 |
B. |
C.当 时,溶液中存在 时,溶液中存在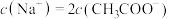 |
D. 、 、 两点对应溶液中,由水电离出的 两点对应溶液中,由水电离出的 a>b a>b |
您最近一年使用:0次
2024-02-10更新
|
85次组卷
|
2卷引用:四川省内江市资中县第二中学2023-2024学年高二上学期12月月考化学试题
名校
2 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸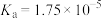 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: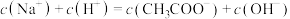
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: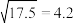 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: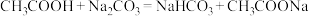
c.NaClO溶液中通入 :
: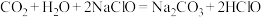
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: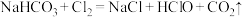
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
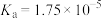 ;碳酸
;碳酸 ,
, 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
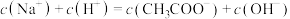
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  |   |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。(已知:
。(已知: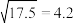 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: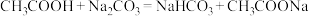
c.NaClO溶液中通入
 :
: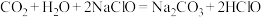
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: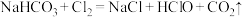
您最近一年使用:0次
名校
解题方法
3 . 化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于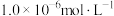 )时,溶液中
)时,溶液中 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
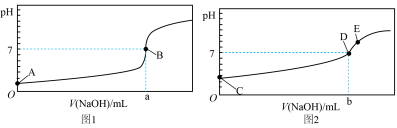
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于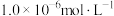 )时,溶液中
)时,溶液中 为
为 (已知
(已知 )。
)。
您最近一年使用:0次
2023-12-18更新
|
303次组卷
|
2卷引用:上海市七宝中学2023-2024学年高三上学期期中考试化学试题
解题方法
4 . 向 溶液中持续滴加稀盐酸,记录溶液
溶液中持续滴加稀盐酸,记录溶液 及温度随时间的变化如图所示。下列说法正确的是
及温度随时间的变化如图所示。下列说法正确的是
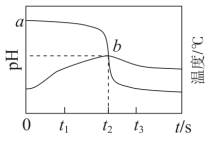
 溶液中持续滴加稀盐酸,记录溶液
溶液中持续滴加稀盐酸,记录溶液 及温度随时间的变化如图所示。下列说法正确的是
及温度随时间的变化如图所示。下列说法正确的是
A. 溶液的起始浓度为 溶液的起始浓度为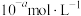 |
| B.在滴定至终点的过程中,水的电离程度不断减小 |
C. 对应的溶液中均存在: 对应的溶液中均存在: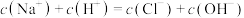 |
D.由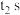 后溶液的温度变化可推知, 后溶液的温度变化可推知, 与 与 的反应是吸热反应 的反应是吸热反应 |
您最近一年使用:0次
2023-01-06更新
|
452次组卷
|
2卷引用:北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷
5 . 按要求填空。
(1)已知室温时, 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中
_______  。
。
②HA的电离平衡常数K=_______ 。
③由HA电离出的 约为水电离出的
约为水电离出的 的
的_______ 倍。
(2)部分弱酸的电离平衡常数如下表:
按要求回答下列问题:
①HCOOH、 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为_______ 。
②同浓度的 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
③运用上述电离常数及物质的特性写出下列反应的离子方程式
i. 溶液中通入过量
溶液中通入过量
_______ 。
ii.过量 通入NaClO溶液中
通入NaClO溶液中_______ 。
(3)已知 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: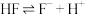 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是_______ (填标号)。
①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
(1)已知室温时,
 某一元酸HA在水中有0.1%发生电离,回答下列问题:
某一元酸HA在水中有0.1%发生电离,回答下列问题:①该溶液中

 。
。②HA的电离平衡常数K=
③由HA电离出的
 约为水电离出的
约为水电离出的 的
的(2)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH |  |  | HClO |
| 电离平衡常数(25℃) | 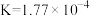 | 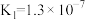 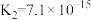 | 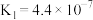 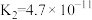 | 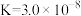 |
①HCOOH、
 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为②同浓度的
 、
、 、
、 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为③运用上述电离常数及物质的特性写出下列反应的离子方程式
i.
 溶液中通入过量
溶液中通入过量
ii.过量
 通入NaClO溶液中
通入NaClO溶液中(3)已知
 的氢氟酸中存在电离平衡:
的氢氟酸中存在电离平衡: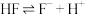 ,要使溶液中
,要使溶液中 增大,可以采取的措施是
增大,可以采取的措施是①加少量烧碱 ②通入少量HCl气体 ③通入少量HF气体 ④加水
您最近一年使用:0次
2022-11-16更新
|
280次组卷
|
2卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
名校
解题方法
7 . 常温下,浓度相同的一元弱酸 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
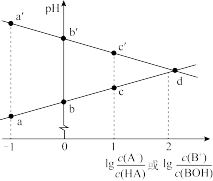
 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
A.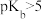 | B.a和a′点的纵坐标之和为14 |
C.水的电离程度: | D.溶液中的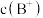 :c点大于c′点 :c点大于c′点 |
您最近一年使用:0次
2022-05-05更新
|
614次组卷
|
3卷引用:山东省济南市2022届高三第二次模拟化学试题
解题方法
8 . 人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
 ),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3
),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3 HCO
HCO +H+的Ka=10−6.1,正常人的血液中c(HCO
+H+的Ka=10−6.1,正常人的血液中c(HCO ):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)
):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)| A.正常人血液内Kw=10-14 |
B.当过量的碱进入血液中时,只发生反应HCO +OH-=CO +OH-=CO +H2O +H2O |
C.正常人血液中存在:c(HCO )+c(OH-)+2c(CO )+c(OH-)+2c(CO )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.由题给数据可算得正常人血液的pH约为7.4 |
您最近一年使用:0次
2022-01-26更新
|
194次组卷
|
2卷引用:浙江省绍兴柯桥区2021-2022学年高二上学期期末教学质量调测化学试题
名校
解题方法
9 . 常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是
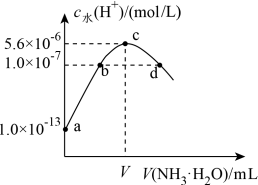

| A.V=40 |
| B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O) |
| C.NH3·H2O的电离常数K=10-4 |
D.d点所示溶液中:c(NH )=2c(SO )=2c(SO ) ) |
您最近一年使用:0次
2022-01-21更新
|
535次组卷
|
16卷引用:2016届山东省临沂市高三下学期教学质检一模化学试卷
2016届山东省临沂市高三下学期教学质检一模化学试卷2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷2016-2017学年辽宁省沈阳铁路中学高二上第一次月考化学试卷江西省景德镇市第一中学2016-2017学年高二(素质班)下学期期末考试化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题百所名校联考-水溶液中的离子平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解中三大守恒的应用2020届高三化学选修4二轮专题练——混合溶液中微粒浓度大小的比较专题【精编23题】江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
10 . 常温下,往20mL0.1mol·L-1NH4HSO4溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离的c水(H+)与所加NaOH溶液体积的关系如图所示(假设:混合后溶液体积的变化忽略不计,整个过程无氨气的逸出)。下列分析正确的是
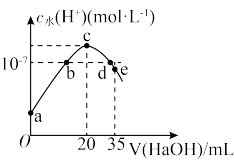
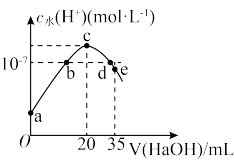
A.a~c之间,主要反应为NH +OH—=NH3·H2O +OH—=NH3·H2O |
| B.b点、d点对应溶液的pH均为7 |
C.d~e之间,溶液中c(Na+)+c(SO )=0.05mol/L )=0.05mol/L |
D.pH=7时,溶液中c(Na+)>c(SO )>c(NH )>c(NH )>c(OH—)=c(H+) )>c(OH—)=c(H+) |
您最近一年使用:0次
2022-01-16更新
|
467次组卷
|
3卷引用:上海市静安区2022届高三一模化学试题



