名校
解题方法
1 . 已知 ℃时,
℃时,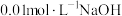 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,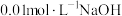 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.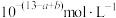 | B. |
C.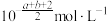 | D.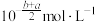 |
您最近一年使用:0次
2023-11-12更新
|
469次组卷
|
3卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
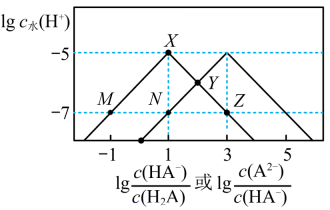
2 . 25℃时,某混合溶液中c(H2A) +c(HA-) +c(A2-) =0.01 mol/L,由水电离出的c水(H+) 的对数lgc水(H+ )与 、
、 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 、
、 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.Ka1(H2A) =10-8 |
| B.Z点时溶液的pH=7 |
| C.M点和N点溶液的组成完全相同 |
| D.从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O |
您最近一年使用:0次
2023-03-16更新
|
899次组卷
|
2卷引用:河南省平许济洛四市2023届高三下学期第二次质量检测理科综合化学试题
解题方法
3 . 已知水在25℃和95℃时,其电离平衡曲线如图所示:
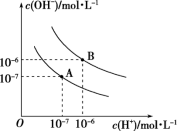
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
您最近一年使用:0次
名校
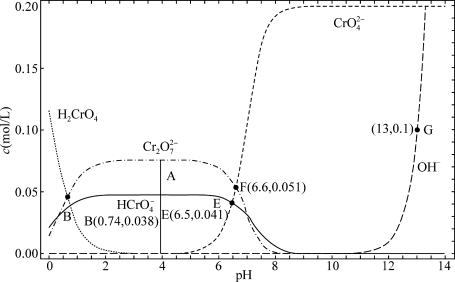
4 . 某温度下,改变0.1mol/L  溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知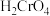 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知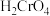 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
A.该温度下的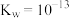 |
B.溶液中存在平衡 ,该温度下此反应的 ,该温度下此反应的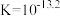 |
C.向0.1mol/L  溶液中加入一定量NaOH固体,溶液橙色变浅 溶液中加入一定量NaOH固体,溶液橙色变浅 |
D.E点溶液中存在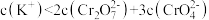 |
您最近一年使用:0次
名校
解题方法
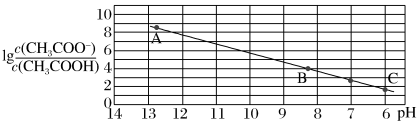
5 . 25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,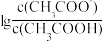 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确 的是
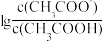 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法
A.pH=11时, 的数量级为106 的数量级为106 |
| B.溶液中,水的电离程度:C >A |
| C.B点存在c(Na+)-c(CH3COO-)=(10-5.8-10-8.2)mol·L-1 |
| D.CH3COONa的水解常数Kh=10-9.7 |
您最近一年使用:0次
2022-01-14更新
|
922次组卷
|
2卷引用:安徽省黄山市2021-2022学年高三上学期第一次理科综合测试化学试题
6 . 已知:①离子浓度为10-5mol/L时可认为沉淀完全;② 。向
。向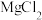 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
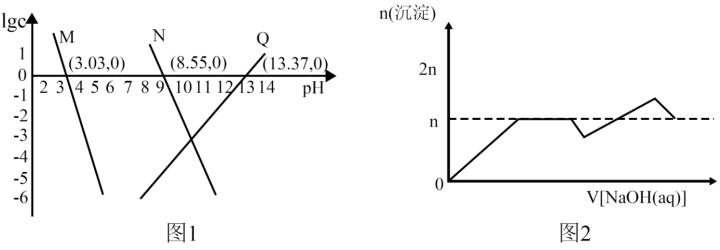
下列说法正确的是:
 。向
。向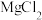 和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
和AlCl3混合溶液中加入NaOH溶液,Mg和Al两种元素在水溶液中的存在形式与pH的关系如图所示,纵轴lg=lgc(Mn+)或lgc([Al(OH)4]-)。
下列说法正确的是:
| A.图1中M代表Mg2+ |
B. |
| C.[Al(OH)4]-完全沉淀时,溶液pH=6.37 |
| D.该实验中,沉淀的物质的量随NaOH溶液体积变化图象如图2 |
您最近一年使用:0次
2021-10-13更新
|
2307次组卷
|
2卷引用:湖北省武昌实验中学2022届高三十月阶段性测试化学试题



