20-21高二·浙江·期中
解题方法
1 . 下列各组离子在指定溶液中一定能大量共存的是
A.由水电离出来的氢离子浓度为10-13mol/L的溶液中:CH3COO-、K+、 、Cl- 、Cl- |
B.能使甲基橙变红的溶液中:K+、Mg2+、 、 、 |
C.c(H+)/c(OH-)=107的溶液:Fe2+、Al3+、 、C1- 、C1- |
D.含有大量Fe3+的溶液: Na+、 Cl-、 、 、 |
您最近一年使用:0次
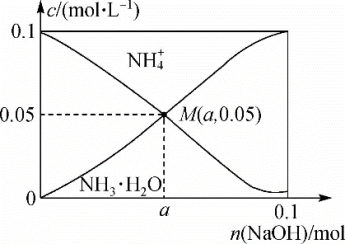
2 . 常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
 与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
与NH3·H2O 的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
| A.M点溶液中水的电离程度比原溶液大 |
| B.在M点时,n(OH-)-n(H+)=(a +0.05)mol |
C.当n(NaOH)=0.05mol时,溶液中有:c(Cl-)>c(Na+)>c(NH )>c(OH-)>c(H+ ) )>c(OH-)>c(H+ ) |
| D.随着NaOH的加入,一定存在c(Cl-)+c(OH-)+c(NH3·H2O)>0.1 mol·L-1 |
您最近一年使用:0次
2021-02-13更新
|
204次组卷
|
2卷引用:广西河池市2021届高三上学期期末教学质量检测理科综合化学试题
名校
解题方法
3 . 盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示明矾可作净水剂的原因:_______ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_______ 。
(3)物质的量浓度相等的下列溶液①NH4Cl;②NH4HSO4;③(NH4)2SO4;④CH3COONH4;⑤NH3·H2O,溶液中的pH由大到小的顺序是_______ (用序号表示)
(4)25℃,两种酸的电离平衡常数如下表:
①0.10mol/L NaHSO3溶液中离子浓度由大到小的顺序为_______ ;
②向Na2S溶液中通入足量二氧化硫时反应的离子方程式_______ 。
③向NaHS溶液中通入少量CO2时反应的离子方程式_______ 。
(1)用离子方程式表示明矾可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)物质的量浓度相等的下列溶液①NH4Cl;②NH4HSO4;③(NH4)2SO4;④CH3COONH4;⑤NH3·H2O,溶液中的pH由大到小的顺序是
(4)25℃,两种酸的电离平衡常数如下表:
| H2SO3 | H2CO3 | H2S | |
| Ka1 | 1.3×10-2 | 4.2×10-7 | 1.9×10-8 |
| Ka2 | 6.3×10-8 | 5.6×10-11 | 1.0×10-12 |
①0.10mol/L NaHSO3溶液中离子浓度由大到小的顺序为
②向Na2S溶液中通入足量二氧化硫时反应的离子方程式
③向NaHS溶液中通入少量CO2时反应的离子方程式
您最近一年使用:0次
名校
4 . 常温下,等体积等物质的量浓度的①氨水②盐酸③氯化铵溶液,下列说法错误的是
A.①中C(NH3·H2O) > C(OH-) > C(NH ) > C(H+) ) > C(H+) |
| B.①②混合后,铵根离子浓度小于③的二分之一 |
C.①③混合后,溶液呈碱性,则C(Cl-) > C(NH ) > C(OH-) ) > C(OH-) |
| D.②溶液中水的电离程度最小 |
您最近一年使用:0次
2020-12-31更新
|
236次组卷
|
2卷引用:上海市奉贤区2021届高三一模化学试卷
名校
解题方法
5 . 设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| B.常温下,2L0.1mol·L-1FeCl3溶液中,Fe3+的数目为0.2NA |
| C.常温下,1L pH=2的硫酸溶液中由水电离出的H+的数目为10-12NA |
| D.常温下,将0.1mol Cl2 溶于水,溶液中的HClO分子数为0.1 NA |
您最近一年使用:0次
名校
解题方法
6 . 下列关于电解质溶液的判断正确的是
A.常温下,在pH=1的溶液中,Fe2+、NO 、ClO-、Na+不能大量共存 、ClO-、Na+不能大量共存 |
B.能使蓝色石蕊试纸变红色的溶液中,Na+、NO 、SO 、SO 、K+可以大量共存 、K+可以大量共存 |
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH 、CH3COO-、S2-可以大量共存 、CH3COO-、S2-可以大量共存 |
D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO 一定不能大量共存 一定不能大量共存 |
您最近一年使用:0次
解题方法
7 . 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.由水电离产生的c(H+)=1×10-13mol·L-1的溶液中:Na+、Ba2+、NO 、Cl- 、Cl- |
B.在含有大量HCO 的溶液中:Na+、NO 的溶液中:Na+、NO 、Cl-、AlO 、Cl-、AlO |
C.1.0 mol·L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、SO |
| D. 0.1mol·L-1的Fe(NO3)2溶液中:Na+、H+、SCN-、Cl- |
您最近一年使用:0次
解题方法
8 . T℃下的某溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示。请回答下列问题:
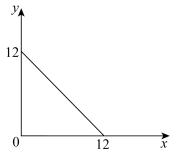
(1)此温度下,水的离子积Kw=________ ,则T________ 25(填“ ”“
”“ ”或
”或 )。
)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=________ ,实验②中由水电离产生的c(OH-)=________ mol/L。
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________ 性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:________ 。
③按甲方式混合后,所得溶液的pH为________ 。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________ (填“ ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。

(1)此温度下,水的离子积Kw=
 ”“
”“ ”或
”或 )。
)。(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol/L的Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol/L NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH为
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a
 ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。
您最近一年使用:0次
2020-09-14更新
|
393次组卷
|
2卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH
名校
解题方法
9 . 下列说法正确的是
| A.常温下,pH=2的HCl溶液中水电离的H+浓度为0.01 mol/L |
| B.0.1 mol/L 醋酸溶液中c(H+) + c(CH3COO-) + c(CH3COOH)= 0.1 mol/L |
| C.已知0.1 mol/L KHC2O4溶液呈酸性,则该溶液中存在如下关系:c(K+) >c(HC2O4-)> c(H2C2O4) >c(C2O42-) |
| D.在Na2CO3溶液中存在如下守恒关系:c(H+)-c(HCO3-)-2c(H2CO3) = c(OH-) |
您最近一年使用:0次
名校
解题方法
10 . 常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
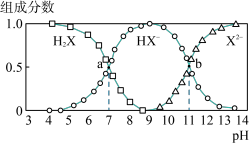

| A.水的电离程度:b点小于点a |
| B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11 |
| C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX- |
| D.常温下,反应X2-+H2O⇌HX-+OH-的平衡常数对数值1gK=-11 |
您最近一年使用:0次
2020-06-22更新
|
180次组卷
|
2卷引用:安徽师范大学附属中学2020届高三6月第九次模拟考试理综化学试题



