名校
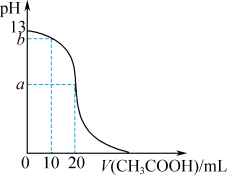
1 . 常温下,量取10.00mL 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
 溶液置于锥形瓶中,加入指示剂,用
溶液置于锥形瓶中,加入指示剂,用 溶液滴定,所得溶液的
溶液滴定,所得溶液的 随
随 溶液体积的变化如图所示,达到滴定终点时,消耗
溶液体积的变化如图所示,达到滴定终点时,消耗 溶液20.00mL。下列说法正确的是
溶液20.00mL。下列说法正确的是
A. 溶液的浓度为 溶液的浓度为 |
B. |
C.当 时,溶液中存在 时,溶液中存在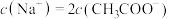 |
D. 、 、 两点对应溶液中,由水电离出的 两点对应溶液中,由水电离出的 a>b a>b |
您最近一年使用:0次
2024-02-10更新
|
85次组卷
|
2卷引用:四川省内江市资中县第二中学2023-2024学年高二上学期12月月考化学试题
名校
2 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、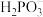 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: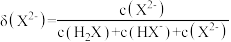 。
。
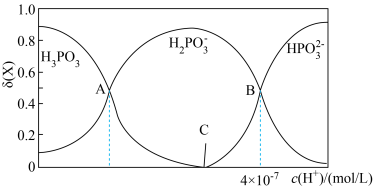
① 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点 ,那C点对应的
,那C点对应的
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中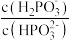 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
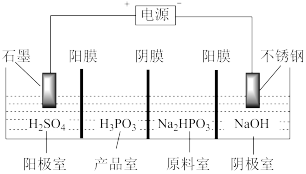
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、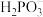 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: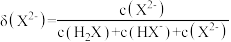 。
。
①
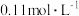 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
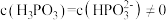 ,那C点对应的
,那C点对应的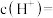
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中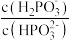 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
I.常温下,一定浓度的 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数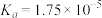 。
。
(1)乙酸钠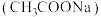 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。 的
的 溶液中:
溶液中: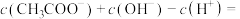
_______  。
。
Ⅱ.常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。

(2)在常温下 的电离平衡常数
的电离平衡常数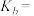
_______ (用含有a的代数式表示)。
Ⅲ. 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:

(3)根据该图判断HA为_______ (填“强酸”或“弱酸”),理由是_______ 。
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会_______ (填“增大”、“减小”或“不变”)。
(5)d点溶液中溶质成分是_______ ,溶液中离子浓度大小关系_______ 。
I.常温下,一定浓度的
 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数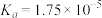 。
。(1)乙酸钠
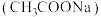 溶液呈碱性的原因是
溶液呈碱性的原因是 的
的 溶液中:
溶液中: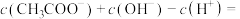
 。
。Ⅱ.常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。
(2)在常温下
 的电离平衡常数
的电离平衡常数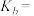
Ⅲ.
 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:
(3)根据该图判断HA为
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会
(5)d点溶液中溶质成分是
您最近一年使用:0次
名校
4 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
Ⅰ.室温下,有浓度均为0.1 mol·L 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
①HCl②NaCl③ ④
④ ⑤
⑤
资料:室温下电离常数,醋酸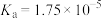 ;碳酸
;碳酸 ,
, 。
。
(1)上述溶液中水的电离被抑制的是_______ (填序号,下同),水的电离被促进的是_______ ,溶液⑤中溶质与水作用的离子方程式表示为_______ 。
(2)上述溶液的pH由大到小的顺序为_______ 。
(3)比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③_______ ④(填“<”、“=”或“>”)。
(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为_______ 。
(5)向20 mL 0.1 mol/L 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。

①滴加过程中发生反应的离子方程式是_______ 。
②下列说法正确的是_______ 。
a. A、C两点水的电离程度:
b.B点溶液中微粒浓度满足: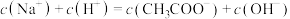
c.D点溶液中微粒浓度满足:
Ⅱ.已知:25°C时 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。
(6) 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
(7)25℃时,等物质的量浓度的NaClO溶液和 溶液中,碱性较强的是
溶液中,碱性较强的是_______ 。
(8)25℃时,若初始时醋酸中 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
_______ mol⋅L 。(已知:
。(已知: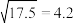 )
)
(9)依据上表数据,下列方程式书写合理的是_______ 。(填字母)(已知: )
)
a. 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b. 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: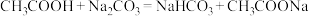
c.NaClO溶液中通入 :
: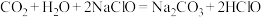
d. 溶液中滴加过量氯水:
溶液中滴加过量氯水: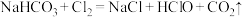
Ⅰ.室温下,有浓度均为0.1 mol·L
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①HCl②NaCl③
 ④
④ ⑤
⑤
资料:室温下电离常数,醋酸
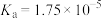 ;碳酸
;碳酸 ,
, 。
。(1)上述溶液中水的电离被抑制的是
(2)上述溶液的pH由大到小的顺序为
(3)比较溶液③和④中
 的物质的量浓度:③
的物质的量浓度:③(4)室温下,向溶液①中加水稀释至原体积的10倍,所得溶液的pH为
(5)向20 mL 0.1 mol/L
 中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
中逐滴加入0.1 mol/L NaOH过程中,pH变化如图所示。
①滴加过程中发生反应的离子方程式是
②下列说法正确的是
a. A、C两点水的电离程度:

b.B点溶液中微粒浓度满足:
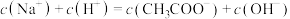
c.D点溶液中微粒浓度满足:

Ⅱ.已知:25°C时
 、
、 和HClO的电离平衡常数如下表。
和HClO的电离平衡常数如下表。| 化学式 |  |  | HClO |
电离平衡常数( ) ) |  |   |  |
(6)
 的电离平衡常数表达式
的电离平衡常数表达式
(7)25℃时,等物质的量浓度的NaClO溶液和
 溶液中,碱性较强的是
溶液中,碱性较强的是(8)25℃时,若初始时醋酸中
 的物质的量浓度为0.01 mol⋅L
的物质的量浓度为0.01 mol⋅L ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。(已知:
。(已知: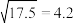 )
)(9)依据上表数据,下列方程式书写合理的是
 )
)a.
 溶液中滴加次氯酸:
溶液中滴加次氯酸:
b.
 溶液中滴加少量醋酸:
溶液中滴加少量醋酸: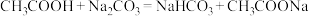
c.NaClO溶液中通入
 :
: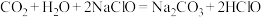
d.
 溶液中滴加过量氯水:
溶液中滴加过量氯水: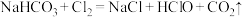
您最近一年使用:0次
5 . 化学是一门实验的科学,滴定法是一种常用的化学定量分析的方法。室温下,用 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
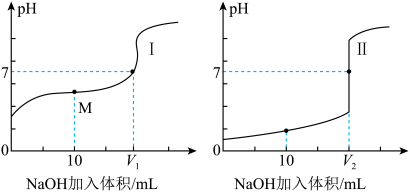
(1)滴定醋酸溶液的曲线是___________ 。(填“Ⅰ”或“Ⅱ”)。
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式___________ 。
(3)滴定开始前,三种溶液中由水电离出的 最大的是
最大的是______ 。
A. 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸
(4)该 溶液的pH为
溶液的pH为______ ;给该溶液加热,pH______ (填“变大”“变小”或“不变”)。
(5)在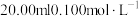 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=___________ 。
(6)取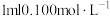 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH=___________ ,此时水电离出的 浓度为
浓度为___________ 。
(7)下列离子一定能大量共存的是___________。
(8)下列叙述正确的是___________。
(9)下列有关实验的说法,正确的是___________。
 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
(1)滴定醋酸溶液的曲线是
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式
(3)滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是A.
 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸(4)该
 溶液的pH为
溶液的pH为(5)在
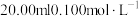 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=(6)取
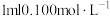 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH= 浓度为
浓度为(7)下列离子一定能大量共存的是___________。
A.甲基橙呈黄色的溶液中: 、 、 、 、 、 、 |
B.加入铝粉后产生大量氢气的溶液中: 、 、 、 、 、 、 |
C.石蕊呈蓝色的溶液中: 、 、 、 、 、 、 |
D.pH=1的溶液中: 、 、 、 、 、 、 |
(8)下列叙述正确的是___________。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下其 |
B.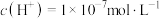 的溶液一定是中性溶液 的溶液一定是中性溶液 |
C.向水中加入少量固体 ,水的电离平衡逆向移动, ,水的电离平衡逆向移动, 减小 减小 |
D.将水加热, 增大,pH不变 增大,pH不变 |
(9)下列有关实验的说法,正确的是___________。
| A.测定HClO溶液pH时,用玻璃棒蘸取溶液,点在干燥pH试纸上 |
| B.等体积、等pH的硫酸与醋酸溶液分别与足量锌反应,醋酸产生的氢气多 |
| C.等体积、等浓度的盐酸和醋酸分别与相同大小的锌粒反应,醋酸初始反应速率快 |
| D.使用pH试纸测定溶液的pH时,若先润湿,则测得溶液的pH一定有误差 |
您最近一年使用:0次
名校
解题方法
6 . Ⅰ. 下的某溶液中,
下的某溶液中,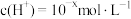 ,
,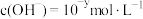 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
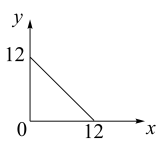
(1)在此温度下,向 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:
假设溶液混合前后的体积变化忽略不计,则
_______ ,实验②中由水电离产生的
_______  。
。
(2)在此温度下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为_______ 。
Ⅱ.在保持体系总压为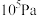 的条件下进行反应:
的条件下进行反应: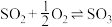 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:

(3)图中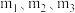 的大小顺序为
的大小顺序为_______ 。
(4)图中A点原料气的成分: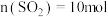 ,
,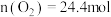 ,
, ,达平衡时
,达平衡时 的分压
的分压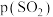 为
为_______  (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
(5)若在容积均为2L的密闭容器内, 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: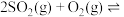
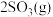
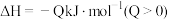 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
三个容器中的反应分别达平衡时下列各组数据关系正确的是_______(填字母)。
Ⅲ. 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: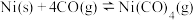
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和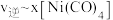 的关系如图所示:
的关系如图所示:
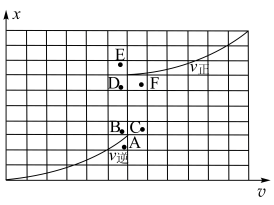
(6)当降低温度时,反应重新达到平衡, 和
和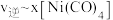 相对应的点分别为
相对应的点分别为_______ 、_______ (填字母)。
 下的某溶液中,
下的某溶液中,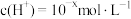 ,
,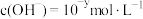 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
(1)在此温度下,向
 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |


 。
。(2)在此温度下,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为Ⅱ.在保持体系总压为
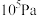 的条件下进行反应:
的条件下进行反应: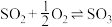 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:
(3)图中
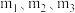 的大小顺序为
的大小顺序为(4)图中A点原料气的成分:
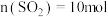 ,
,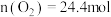 ,
, ,达平衡时
,达平衡时 的分压
的分压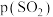 为
为 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。(5)若在容积均为2L的密闭容器内,
 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: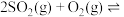
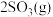
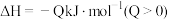 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 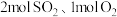 | 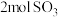 |  |
平衡时n( ) ) |  |  |  |
| 反应的能量变化 | 放出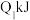 | 吸收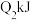 | 放出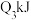 |
| 体系的压强 |  |  |  |
| 反应物的转化率 |  |  | 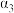 |
A.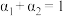 |
B.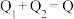 |
C. |
D. |
E. |
F.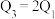 |
Ⅲ.
 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: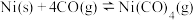
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和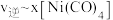 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡,
 和
和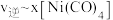 相对应的点分别为
相对应的点分别为
您最近一年使用:0次
解题方法
7 . 草酸 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中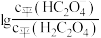 或
或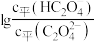 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 是二元弱酸,常温下,用
是二元弱酸,常温下,用 溶液滴定草酸溶液,溶液中
溶液滴定草酸溶液,溶液中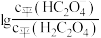 或
或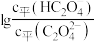 与混合溶液
与混合溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.草酸的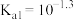 | B.水的电离程度 |
C. 点时, 点时, | D.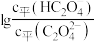 随溶液 随溶液 的变化为曲线Ⅱ 的变化为曲线Ⅱ |
您最近一年使用:0次
2023-12-03更新
|
310次组卷
|
2卷引用:山东省日照市2023-2024学年高二上学期期中校际联合考试化学试题
名校
解题方法
8 . 已知 ℃时,
℃时,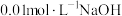 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,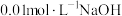 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.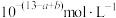 | B. |
C.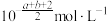 | D.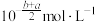 |
您最近一年使用:0次
2023-11-12更新
|
469次组卷
|
3卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
9 . Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
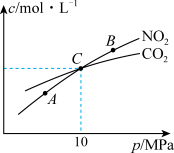
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
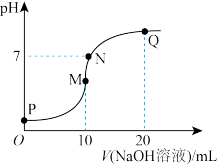
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
 )
)b.N点c(NH
 )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)c.Q点c(NH
 )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
您最近一年使用:0次
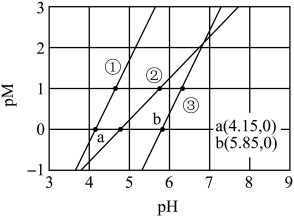
10 . 常温下,向含有 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示 或
或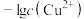 或
或 ]。
]。
已知: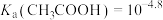 ,
,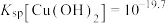 。若溶液中离子浓度小于
。若溶液中离子浓度小于 ,认为该离子沉淀完全。下列说法不正确的是
,认为该离子沉淀完全。下列说法不正确的是
 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示 或
或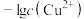 或
或 ]。
]。已知:
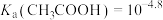 ,
,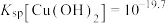 。若溶液中离子浓度小于
。若溶液中离子浓度小于 ,认为该离子沉淀完全。下列说法不正确的是
,认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示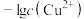 与pH的关系 与pH的关系 |
B. 时,溶液中 时,溶液中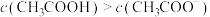 |
C. 时,可认为 时,可认为 沉淀完全 沉淀完全 |
D. 时, 时,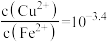 |
您最近一年使用:0次
2023-04-19更新
|
1579次组卷
|
5卷引用:四川省泸州市泸县第四中学2023-2024学年高二上学期12月月考化学试题
四川省泸州市泸县第四中学2023-2024学年高二上学期12月月考化学试题广东省广州市2023届高三二模考试化学试题(已下线)押题密卷 03-【热题狂飙】2023年高考化学样卷(全国卷专用)辽宁省沈阳市第二中学2023届高三下学期第六次模拟考试化学试题广东省肇庆市德庆县香山中学2023-2024学年高三上学期9月月考化学试题



