名校
解题方法
1 . 常温下,下列关于电解质溶液的正确判断是
A.在pH=12的溶液中,Al3+、Cl-、CO 、Na+可以大量共存 、Na+可以大量共存 |
B.在pH=0的溶液中,Na+、NO 、SO 、SO 、K+可以大量共存 、K+可以大量共存 |
C.由水电离出的氢离子浓度为1.0×10-12mol•L-1溶液中,K+、Cl-、HCO 、Na+可以大量共存 、Na+可以大量共存 |
| D.由0.1mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O⇌HA+OH- |
您最近一年使用:0次
名校
解题方法
2 . 常温,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中: I-、NO 、SO 、SO 、Na+ 、Na+ |
B.由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO |
C.c(H+)/c(OH-)=1012的溶液中: NH 、Al3+、NO 、Al3+、NO 、Cl- 、Cl- |
D.能使KSCN溶液变红的溶液中:SO 、HCO 、HCO 、Na+、Cl- 、Na+、Cl- |
您最近一年使用:0次
名校
解题方法
3 . 设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| B.常温下,2L0.1mol·L-1FeCl3溶液中,Fe3+的数目为0.2NA |
| C.常温下,1L pH=2的硫酸溶液中由水电离出的H+的数目为10-12NA |
| D.常温下,将0.1mol Cl2 溶于水,溶液中的HClO分子数为0.1 NA |
您最近一年使用:0次
名校
解题方法
4 . 下列关于电解质溶液的判断正确的是
A.常温下,在pH=1的溶液中,Fe2+、NO 、ClO-、Na+不能大量共存 、ClO-、Na+不能大量共存 |
B.能使蓝色石蕊试纸变红色的溶液中,Na+、NO 、SO 、SO 、K+可以大量共存 、K+可以大量共存 |
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH 、CH3COO-、S2-可以大量共存 、CH3COO-、S2-可以大量共存 |
D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO 一定不能大量共存 一定不能大量共存 |
您最近一年使用:0次
名校
5 . 燃煤排放大量CO2、SO2、NOx以及固体颗粒物,对环境污染严重。回答下列问题:
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是________ 。
(2)升高温度时,反应②中H2的产率_____ (填“增大”、“减小”或“不变”)。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式________ 。
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为______________ ,0.1 mol/L KHCO3溶液的pH>8,则溶液中c(H2CO3)________ (填“>”“=”或“<”)c(CO )。
)。
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是
(2)升高温度时,反应②中H2的产率
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为
 )。
)。
您最近一年使用:0次
名校
解题方法
6 . 常温下,用物质的量浓度为amol•L-1的NaOH稀溶液滴定0.1mol•L-1某酸HA溶液,溶液中水电离出的c水(H+)的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法正确
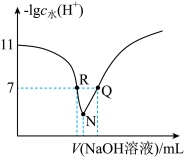

| A.N点溶液显酸性 |
| B.Ka(HA)的值约为10-5 |
| C.R点溶液中:c(Na+)<c(A-) |
| D.Q点溶液中:c(Na+)=c(A-)+c(HA) |
您最近一年使用:0次
2020-11-07更新
|
871次组卷
|
8卷引用:河南省三门峡市外国语高级中学2020-2021学年高二上学期期中考试化学试题
解题方法
7 . T℃下的某溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示。请回答下列问题:
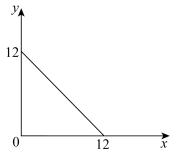
(1)此温度下,水的离子积Kw=________ ,则T________ 25(填“ ”“
”“ ”或
”或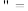 )。
)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=________ ,实验②中由水电离产生的c(OH-)=________ mol/L。
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________ 性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:________ 。
③按甲方式混合后,所得溶液的pH为________ 。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________ (填“ ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。

(1)此温度下,水的离子积Kw=
 ”“
”“ ”或
”或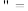 )。
)。(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=
(3)在此温度下,将0.1mol/L的NaHSO4溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol/L的Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol/L NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH为
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a
 ”“
”“ ”或“
”或“ ”)0.01。
”)0.01。
您最近一年使用:0次
2020-09-14更新
|
393次组卷
|
2卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH
名校
解题方法
8 . 常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
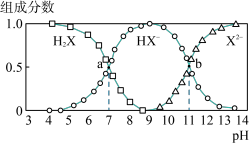

| A.水的电离程度:b点小于点a |
| B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11 |
| C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX- |
| D.常温下,反应X2-+H2O⇌HX-+OH-的平衡常数对数值1gK=-11 |
您最近一年使用:0次
2020-06-22更新
|
180次组卷
|
2卷引用:四川省内江市第六中学2019-2020学年高二下学期第二次月考理综化学试题
名校
9 . 已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
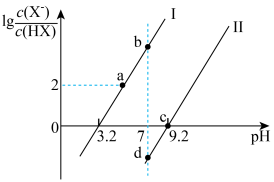
 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
A.直线I对应的是 |
| B.I中a点到b点的过程中水的电离程度逐渐增大 |
C.c点溶液中: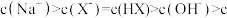  |
| D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+) |
您最近一年使用:0次
2020-04-17更新
|
976次组卷
|
5卷引用:湖南师范大学附属中学2022-2023学年高二上学期第二次大练习化学试题
10 . T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
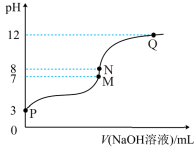
下列说法不正确的是( )

下列说法不正确的是( )
| A..T℃时,HR电离常数Ka≈1.0×10-5 |
| B.M点对应的NaOH溶液体积为20.00mL |
| C.N点与Q点所示溶液中水的电离程度:N>Q |
| D.M点所示溶液中c(Na+)=c(R-) |
您最近一年使用:0次
2020-03-26更新
|
670次组卷
|
6卷引用:湖南省长郡中学2021-2022学年高二上学期期末考试化学试题



