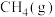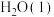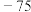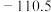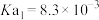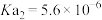燃煤排放大量CO2、SO2、NOx以及固体颗粒物,对环境污染严重。回答下列问题:
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是________ 。
(2)升高温度时,反应②中H2的产率_____ (填“增大”、“减小”或“不变”)。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式________ 。
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为______________ ,0.1 mol/L KHCO3溶液的pH>8,则溶液中c(H2CO3)________ (填“>”“=”或“<”)c(CO )。
)。
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g) =CO2(g) ΔH1 < 0 ①
途径Ⅱ:C(s)+H2O(g) =CO(g)+H2(g) ΔH2 > 0 ②
2CO(g)+O2(g) =2CO2(g) ΔH3 < 0 ③
2H2(g)+O2(g) =2H2O(g) ΔH4 < 0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是
(2)升高温度时,反应②中H2的产率
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)可用K2CO3溶液吸收燃煤反应生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为
 )。
)。
更新时间:2020-12-01 15:52:20
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】深入研究碳、氮元素的物质转化有着重要的实际意义。N2O、CO在Pt2O+的表面进行两步反应转化为无毒的气体,其相对能量、反应历程和熵值(298.15K,100Kpa时)如图甲、乙所示。
I: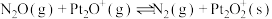
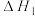
II:
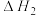
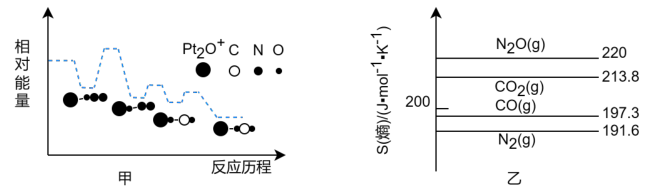
将等物质的量的N2O和CO充入一密闭容器中进行反应,请回答:
(1)总反应的热化学方程式为_______ ( 用含
用含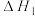 、
、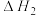 的式子表示)。
的式子表示)。
(2)下列说法正确的是_______。
(3)在T1℃,平衡时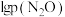 与
与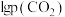 的关系如图丙所示,p为物质的分压强(单位为kPa)。若
的关系如图丙所示,p为物质的分压强(单位为kPa)。若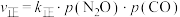 、
、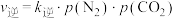 ,则
,则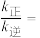
_______ 。(分压=总压×物质的量分数)。

(4)若在相同时间内测得N2O的转化率随温度的变化曲线如图丁所示,N2O的转化率在400℃~900℃之间下降由缓到急的原因是_______ 。
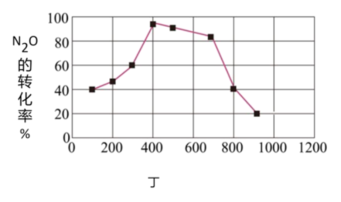
(5)在图丁中画出900℃以后,相同时间内N2O的转化率随温度的变化曲线_______ 。
I:
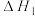
II:

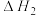

将等物质的量的N2O和CO充入一密闭容器中进行反应,请回答:
(1)总反应的热化学方程式为
 用含
用含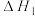 、
、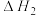 的式子表示)。
的式子表示)。(2)下列说法正确的是_______。
| A.在恒温,恒容时,混合气体的密度不再变化说明体系达到平衡状态 |
| B.该总反应高温下可能不自发 |
| C.反应过程中先是N2O中的O原子去进攻Pt2O+中的Pt原子 |
| D.研究表明,Pt2O+一步催化相对于上述反应历程具有更少的反应步骤和更低的活化能,所以平衡转化率更大 |
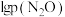 与
与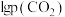 的关系如图丙所示,p为物质的分压强(单位为kPa)。若
的关系如图丙所示,p为物质的分压强(单位为kPa)。若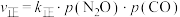 、
、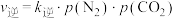 ,则
,则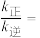

(4)若在相同时间内测得N2O的转化率随温度的变化曲线如图丁所示,N2O的转化率在400℃~900℃之间下降由缓到急的原因是

(5)在图丁中画出900℃以后,相同时间内N2O的转化率随温度的变化曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】党的二十大报告提出,未来我国将用更高的标准统筹减污降碳,所以深入研究碳氨元素的物质转化有着重要的实际意义,工业上合成尿素的反应: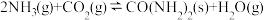
 。
。
已知合成尿素的反应分两步进行:
①
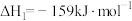
②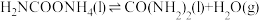
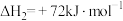
回答下列问题:
(1)总反应的ΔH=_____ kJ·mol-1,ΔS_______ 0 (填“>”或“<”)。已知活化能Ea1远小于Ea2,某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是___________ 。
(2)一定温度下,若向某恒容密闭容器中加入等物质的量的NH3和CO2,发生上述总反应。下列叙述不能说明总反应已经达到平衡状态的是________(填标号)。
(3)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因______ (填标号)。
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨结合水,促进反应②正向移动
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:
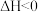 ,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
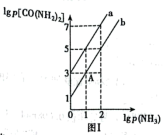
①若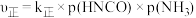 ,
,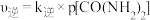 。T1℃对应的平衡曲线是
。T1℃对应的平衡曲线是______ (填“a”或“b”),此时
____ kPa-1。
②若点A 时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数________ (填“变大”“变小”或“不变”)。
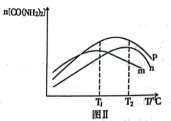
③图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃催化效率最好的是催化剂________ (填序号)。T2℃以上,n[CO(NH2)2]下降的原因可能是___________ (答出一点即可,不考虑物质的稳定性)。
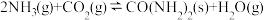
 。
。已知合成尿素的反应分两步进行:
①

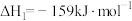
②
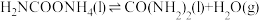
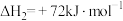
回答下列问题:
(1)总反应的ΔH=
(2)一定温度下,若向某恒容密闭容器中加入等物质的量的NH3和CO2,发生上述总反应。下列叙述不能说明总反应已经达到平衡状态的是________(填标号)。
| A.断裂 6mol N—H 键的同时断裂 2mol O—H 键 | B.压强不再变化 |
| C.混合气体的密度不再变化 | D.CO2体积分数不再变化 |
(3)工业合成尿素中,通常氨气、二氧化碳投料比大于2,请分析可能原因
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨结合水,促进反应②正向移动
(4)在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的两种反应物,发生以下反应:

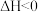 ,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
,平衡时lg p(NH3)与lg p[CO(NH2)2]的关系如图Ⅰ所示,p为物质的分压强(单位为kPa)。
①若
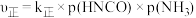 ,
,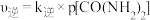 。T1℃对应的平衡曲线是
。T1℃对应的平衡曲线是
②若点A 时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数
③图Ⅱ为在不同催化剂下,反应至相同时间容器中尿素的物质的量随温度变化的曲线,则在T1℃催化效率最好的是催化剂

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】二十大报告指出,“必须牢固树立和践行绿水青山就是金山银山的理念。”用 与
与 反应,既可提高燃烧效率,又能得到化工生产所需
反应,既可提高燃烧效率,又能得到化工生产所需 ,其中反应I为主反应,反应Ⅱ为副反应。
,其中反应I为主反应,反应Ⅱ为副反应。
Ⅰ.
Ⅱ.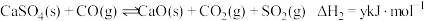
回答下列问题:
(1)已知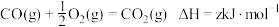 。以反应Ⅰ中生成的
。以反应Ⅰ中生成的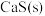 为原料,在一定条件下经原子利用率100%的高温反应,可再生
为原料,在一定条件下经原子利用率100%的高温反应,可再生 ,该反应的热化学方程式为
,该反应的热化学方程式为_______ 。
(2)反应Ⅰ、Ⅱ的平衡常数的对数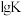 随反应温度T的变化曲线如图所示[a点坐标为
随反应温度T的变化曲线如图所示[a点坐标为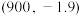 ,b点坐标为
,b点坐标为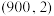 ]。
]。
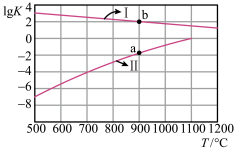
①向盛有 的真空恒容密闭容器中充入
的真空恒容密闭容器中充入 ,反应Ⅰ、Ⅱ于
,反应Ⅰ、Ⅱ于 达到平衡,
达到平衡, 的平衡浓度
的平衡浓度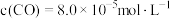 。体系中
。体系中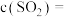
_______  ,
, 的转化率为
的转化率为_______ 。若平衡体系中再充入一定量 和
和 ,使
,使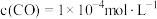 、
、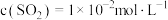 ,反应Ⅱ将
,反应Ⅱ将_______ (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
②为降低该反应体系中 的物质的量,可采取的措施有
的物质的量,可采取的措施有_______ 。
a.温度不变,减小真空恒容密闭容器的体积
b.在合适的温度区间内控制较低的反应温度
c.温度不变,提高 的初始加入量
的初始加入量
d.分离出 气体
气体
(3)将生成的 用
用 溶液吸收,得到
溶液吸收,得到 溶液。下图是在不同
溶液。下图是在不同 下不同形态的含碳粒子的分布分数图像(a、b、c三点对应的
下不同形态的含碳粒子的分布分数图像(a、b、c三点对应的 分别为6.37、8.25、10.25)。
分别为6.37、8.25、10.25)。
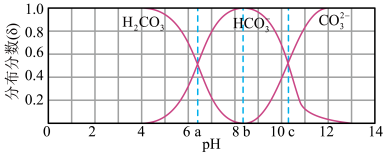
实验测定,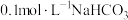 溶液的
溶液的 ,则该溶液中
,则该溶液中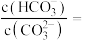
_______ ,溶液中阴离子浓度由大到小的顺序为_______ 。
 与
与 反应,既可提高燃烧效率,又能得到化工生产所需
反应,既可提高燃烧效率,又能得到化工生产所需 ,其中反应I为主反应,反应Ⅱ为副反应。
,其中反应I为主反应,反应Ⅱ为副反应。Ⅰ.

Ⅱ.
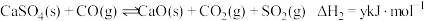
回答下列问题:
(1)已知
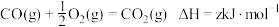 。以反应Ⅰ中生成的
。以反应Ⅰ中生成的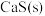 为原料,在一定条件下经原子利用率100%的高温反应,可再生
为原料,在一定条件下经原子利用率100%的高温反应,可再生 ,该反应的热化学方程式为
,该反应的热化学方程式为(2)反应Ⅰ、Ⅱ的平衡常数的对数
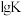 随反应温度T的变化曲线如图所示[a点坐标为
随反应温度T的变化曲线如图所示[a点坐标为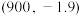 ,b点坐标为
,b点坐标为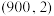 ]。
]。
①向盛有
 的真空恒容密闭容器中充入
的真空恒容密闭容器中充入 ,反应Ⅰ、Ⅱ于
,反应Ⅰ、Ⅱ于 达到平衡,
达到平衡, 的平衡浓度
的平衡浓度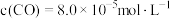 。体系中
。体系中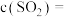
 ,
, 的转化率为
的转化率为 和
和 ,使
,使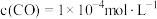 、
、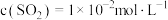 ,反应Ⅱ将
,反应Ⅱ将②为降低该反应体系中
 的物质的量,可采取的措施有
的物质的量,可采取的措施有a.温度不变,减小真空恒容密闭容器的体积
b.在合适的温度区间内控制较低的反应温度
c.温度不变,提高
 的初始加入量
的初始加入量d.分离出
 气体
气体(3)将生成的
 用
用 溶液吸收,得到
溶液吸收,得到 溶液。下图是在不同
溶液。下图是在不同 下不同形态的含碳粒子的分布分数图像(a、b、c三点对应的
下不同形态的含碳粒子的分布分数图像(a、b、c三点对应的 分别为6.37、8.25、10.25)。
分别为6.37、8.25、10.25)。
实验测定,
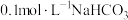 溶液的
溶液的 ,则该溶液中
,则该溶液中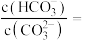
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
真题
解题方法
【推荐1】我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=_______ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______ 。
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
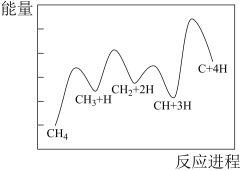
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______ 步进行,其中,第_______ 步的正反应活化能最大。
(4)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
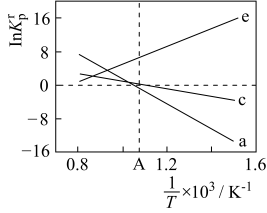
①反应a、c、e中,属于吸热反应的有_______ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=_______ 。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:_______ 。
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c)CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d)2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e)CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(4)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氢能源具有广泛的应用前景,甲烷水蒸气催化重整是制高纯氢的方法之一,涉及反应如下:
Ⅰ.

Ⅱ.

Ⅲ.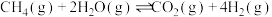
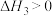
回答下列问题:
(1) 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其 为零。部分物质的标准摩尔生成焓如下表。
为零。部分物质的标准摩尔生成焓如下表。
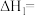
_______  [已知:
[已知:
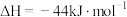 ]。
]。
(2)某温度下, 和
和 按投料比
按投料比 加入容积2L的密闭容器中催化重整制取高纯氢,初始压强为
加入容积2L的密闭容器中催化重整制取高纯氢,初始压强为 ,平衡时
,平衡时 的转化率为
的转化率为 ,
,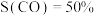 (S表示选择性,
(S表示选择性,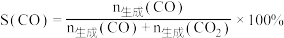 ),则
),则 分压为
分压为_______ ,反Ⅱ的
_______ (保留小数点后两位);在该温度下的平衡体系升温,随着温度的升高, 的转化率先减小后增大的原因可能是
的转化率先减小后增大的原因可能是_______ 。
(3)用CaO可以去除 。
。 体积分数和CaO消耗率随时间变化关系如图所示。从
体积分数和CaO消耗率随时间变化关系如图所示。从 时开始,
时开始, 体积分数显著降低,单位时间CaO消耗率降低。此时CaO消耗率约为
体积分数显著降低,单位时间CaO消耗率降低。此时CaO消耗率约为 ,大部分已失效,原因是
,大部分已失效,原因是_______ 。 ,调整CO和
,调整CO和 初始投料比,测得CO的平衡转化率如图。
初始投料比,测得CO的平衡转化率如图。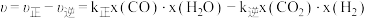 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。A、B、D、E四点中温度最高的是
分别为正、逆向反应速率常数,x为物质的量分数。A、B、D、E四点中温度最高的是_______ ,在C点所示投料比下,当CO转化率达到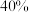 时,
时,
_______ 。
Ⅰ.


Ⅱ.


Ⅲ.
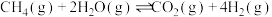
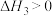
回答下列问题:
(1)
 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其 为零。部分物质的标准摩尔生成焓如下表。
为零。部分物质的标准摩尔生成焓如下表。物质 |
|
|
|
|
|
|
|
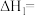
 [已知:
[已知:
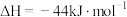 ]。
]。(2)某温度下,
 和
和 按投料比
按投料比 加入容积2L的密闭容器中催化重整制取高纯氢,初始压强为
加入容积2L的密闭容器中催化重整制取高纯氢,初始压强为 ,平衡时
,平衡时 的转化率为
的转化率为 ,
,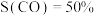 (S表示选择性,
(S表示选择性,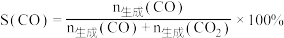 ),则
),则 分压为
分压为
 的转化率先减小后增大的原因可能是
的转化率先减小后增大的原因可能是(3)用CaO可以去除
 。
。 体积分数和CaO消耗率随时间变化关系如图所示。从
体积分数和CaO消耗率随时间变化关系如图所示。从 时开始,
时开始, 体积分数显著降低,单位时间CaO消耗率降低。此时CaO消耗率约为
体积分数显著降低,单位时间CaO消耗率降低。此时CaO消耗率约为 ,大部分已失效,原因是
,大部分已失效,原因是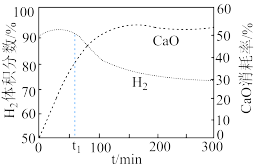
 ,调整CO和
,调整CO和 初始投料比,测得CO的平衡转化率如图。
初始投料比,测得CO的平衡转化率如图。
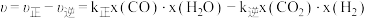 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。A、B、D、E四点中温度最高的是
分别为正、逆向反应速率常数,x为物质的量分数。A、B、D、E四点中温度最高的是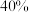 时,
时,
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业采用高温分解H2S制取氢气,2H2S(g) 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g) 2H2(g) + S2(g)的ΔH
2H2(g) + S2(g)的ΔH_________ (填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________ 。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________ 。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。

①在图示的转化中,化合价不变的元素是____________ 。
②在温度一定和不补加 溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________ 。

(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________ 。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________ 。
(1)工业采用高温分解H2S制取氢气,2H2S(g)
 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
①反应2H2S(g)
 2H2(g) + S2(g)的ΔH
2H2(g) + S2(g)的ΔH②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。

①在图示的转化中,化合价不变的元素是
②在温度一定和

(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】氰化钠(NaCN)是一种重要的化工原料,在工业上有许多用途。NaCN有剧毒,含氰废水的工业处理流程如图所示。
已知:Ka(HCN)< Ka(CH3COOH),[Ag(CN)2]-(aq) Ag+(aq)+2CN-(aq)。
Ag+(aq)+2CN-(aq)。
(1)氰化钠遇水会产生剧毒氢氰酸,写出该反应的离子方程式:_____________________________ 。
当物质的量浓度相同时,CH3COOH中水电离出的c(H+)_____________ (填“大于”、“小于”或“等于”)HCN中水电离出的c(H+)。
(2)向发生塔中通入水蒸气的目的是____________________________________________________ 。
(3)氧化池中,C1O2可将CN-氧化。且产生两种无毒气体,当反应过程中转移了 6.02×1023个电子时,生成标准状况下气体的总体积是_____________ L。
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体和一种常见的酸式盐,写出该反应的离子方程式:_______________________________________________________ 。
(5)电镀厂电镀银时需要降低镀层金属的沉积速率,使镀层更加致密。若电解液使用Na[Ag(CN)2]溶液,则阴极反应式为__________________________________________ ;解释工业电镀中使用氰离子(CN-)的原因:_______________________________________ 。
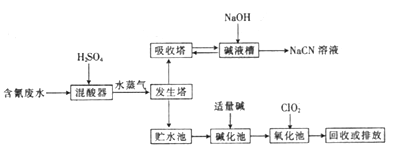
已知:Ka(HCN)< Ka(CH3COOH),[Ag(CN)2]-(aq)
 Ag+(aq)+2CN-(aq)。
Ag+(aq)+2CN-(aq)。(1)氰化钠遇水会产生剧毒氢氰酸,写出该反应的离子方程式:
当物质的量浓度相同时,CH3COOH中水电离出的c(H+)
(2)向发生塔中通入水蒸气的目的是
(3)氧化池中,C1O2可将CN-氧化。且产生两种无毒气体,当反应过程中转移了 6.02×1023个电子时,生成标准状况下气体的总体积是
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体和一种常见的酸式盐,写出该反应的离子方程式:
(5)电镀厂电镀银时需要降低镀层金属的沉积速率,使镀层更加致密。若电解液使用Na[Ag(CN)2]溶液,则阴极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】①醋酸、②盐酸、③一水合氨、④碳酸氢钠、⑤氯化钙、⑥氯化铵是实验室中的常见物质。
(1)写出一水合氨的电离方程式___________ 。
(2)碳酸氢钠溶液显碱性,结合化学用语解释原因:___________ 。
(3)有关0.1mol·L-1 CH3COOH溶液的叙述正确的是___________ 。
a.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(OH-)>c(H+)
b.常温下,等物质的量浓度、等体积CH3COOH溶液与NaOH溶液混合后溶液pH=7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.与同浓度盐酸溶液的导电性相同
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是___________ 。
(5)向饱和NaHCO3溶液中滴加饱和CaCl2溶液,可观察到先产生白色沉淀,后产生大量无色气泡,结合化学用语,从平衡移动角度解释原因___________ 。
(1)写出一水合氨的电离方程式
(2)碳酸氢钠溶液显碱性,结合化学用语解释原因:
(3)有关0.1mol·L-1 CH3COOH溶液的叙述正确的是
a.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(OH-)>c(H+)
b.常温下,等物质的量浓度、等体积CH3COOH溶液与NaOH溶液混合后溶液pH=7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.与同浓度盐酸溶液的导电性相同
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是
(5)向饱和NaHCO3溶液中滴加饱和CaCl2溶液,可观察到先产生白色沉淀,后产生大量无色气泡,结合化学用语,从平衡移动角度解释原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】酸碱的研究具有重要意义。
I.25℃时,三种酸的电离平衡常数如表所示。
(1)浓度均为0.1mol/L的 、HClO、
、HClO、 溶液中,
溶液中, 由大到小的排列是
由大到小的排列是________ 。
(2)亚磷酸 为二元酸,其电离方程式为
为二元酸,其电离方程式为________  是
是________ (填“酸式盐”、“碱式盐”或“正盐”)。
II.常温下,浓度均为 、体积均为
、体积均为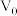 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随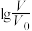 的变化如图所示。
的变化如图所示。
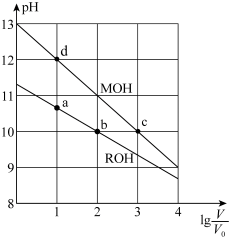
(3)MOH的电离程度c点________ d点(填“>”,“<”或“=”)
(4)加水稀释过程中,ROH溶液中下列表达式的数值变大的是________(填字母)。
(5) 时,MOH和ROH溶液中,
时,MOH和ROH溶液中,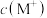
________ 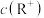 (填“>”,“<”或“=”)
(填“>”,“<”或“=”)
(6)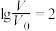 时,MOH和ROH两种溶液中,水电离的
时,MOH和ROH两种溶液中,水电离的 的比值是
的比值是________ 。
I.25℃时,三种酸的电离平衡常数如表所示。
化学式 |
| HClO |
|
电离平衡常数 |
|
|
|
 、HClO、
、HClO、 溶液中,
溶液中, 由大到小的排列是
由大到小的排列是(2)亚磷酸
 为二元酸,其电离方程式为
为二元酸,其电离方程式为 是
是II.常温下,浓度均为
 、体积均为
、体积均为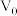 的MOH和ROH溶液,分别加水稀释至体积V,pH随
的MOH和ROH溶液,分别加水稀释至体积V,pH随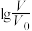 的变化如图所示。
的变化如图所示。
(3)MOH的电离程度c点
(4)加水稀释过程中,ROH溶液中下列表达式的数值变大的是________(填字母)。
A. | B.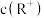 | C. | D.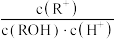 |
 时,MOH和ROH溶液中,
时,MOH和ROH溶液中,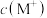
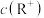 (填“>”,“<”或“=”)
(填“>”,“<”或“=”)(6)
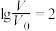 时,MOH和ROH两种溶液中,水电离的
时,MOH和ROH两种溶液中,水电离的 的比值是
的比值是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为____________________ 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3________ 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是________ (填字母代号)。
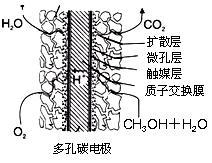
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为__________
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:_____________________ ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,溶液的pH=7,则溶液中c(Na+)+c(H+)____ c(NO )+c(OH-)(填“>”“=”或“<”)
)+c(OH-)(填“>”“=”或“<”)
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图2所示。下列说法正确的是
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为

(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:
 )+c(OH-)(填“>”“=”或“<”)
)+c(OH-)(填“>”“=”或“<”)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】回答下列问题
(1)根据相关物质的电离常数(25℃),回答下列问题:
①
 HCN
HCN 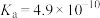

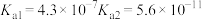
相同pH的① ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:______ 。
②室温时 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为______ 
③实验室在制备 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因______ 。
(2)常温下,将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随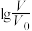 的变化如图所示。
的变化如图所示。______ (填写序号)。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸( )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
常温下,已知 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为______ 。
(4)利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
某次实验抽取血样10.00mL,加适量的草酸铵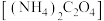 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的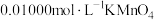 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。
相关离子方程式为: 。
。
①达到滴定终点的现象是______ 。
②血液样品中 浓度为
浓度为______  (保留4位有效数字)。
(保留4位有效数字)。
③下列操作可使所测结果偏高的是______ (填标号)。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: 的电离常数K=
的电离常数K=______ (保留一位有效数字)
②比较b、c、d三点时的溶液中,由水电离出的 由大到小顺序为
由大到小顺序为______ 。
③根据以上滴定曲线判断下列说法正确的是______ (溶液中N元素只存在 和
和 两种形式)。
两种形式)。
A.点b所示溶液中: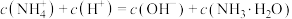
B.点c所示溶液中:
C.点d所示溶液中: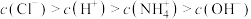
D.滴定过程中可能有: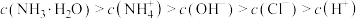
(1)根据相关物质的电离常数(25℃),回答下列问题:
①

 HCN
HCN 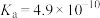

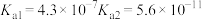
相同pH的①
 ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:②室温时
 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为
③实验室在制备
 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因(2)常温下,将pH均为3,体积均为
 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随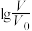 的变化如图所示。
的变化如图所示。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸(
 )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。常温下,已知
 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。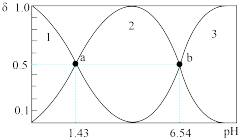
 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为(4)利用草酸(
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。某次实验抽取血样10.00mL,加适量的草酸铵
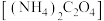 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的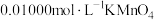 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。相关离子方程式为:
 。
。①达到滴定终点的现象是
②血液样品中
 浓度为
浓度为 (保留4位有效数字)。
(保留4位有效数字)。③下列操作可使所测结果偏高的是
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为
 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: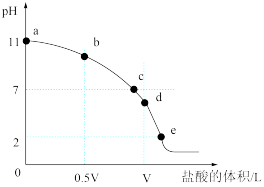
 的电离常数K=
的电离常数K=②比较b、c、d三点时的溶液中,由水电离出的
 由大到小顺序为
由大到小顺序为③根据以上滴定曲线判断下列说法正确的是
 和
和 两种形式)。
两种形式)。A.点b所示溶液中:
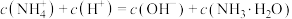
B.点c所示溶液中:

C.点d所示溶液中:
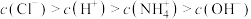
D.滴定过程中可能有:
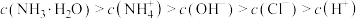
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:
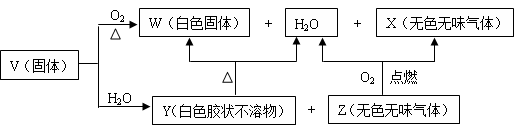
(1)写出W物质的一种用途______________ 。
(2)写出V与足量NaOH溶液反应的化学方程式___________________ 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为________________ 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式__________________ 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是____________ 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为____________ (体积变化忽略不计,结果保留三位有效数字)。

(1)写出W物质的一种用途
(2)写出V与足量NaOH溶液反应的化学方程式
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为
您最近一年使用:0次