名校
1 . 25℃时,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是

 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
A.a点溶液中水电离出的 小于 小于 |
| B.温度升高,c点溶液的pH减小 |
C.滴定过程,溶液中 不变 不变 |
D.25℃时,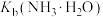 的数量级为 的数量级为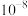 |
您最近一年使用:0次
2023-07-16更新
|
676次组卷
|
3卷引用:四川省成都外国语学校2023-2024学年高二上学期11月期中考试化学试题
名校
2 . 常温下,将0.1 mol∙L−1NaOH溶液滴加到20mL0.1 mol∙L−1二元弱酸H2A溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是
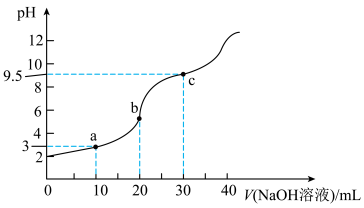

| A.Ka1(H2A)≈10−3 |
| B.b处溶质为NaHA,所以促进水的电离 |
| C.b点时溶液中存在c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(H2A) |
| D.c点时溶液中存在c(Na+)﹣c(HA﹣)−2c(A2﹣)=10−4.5−10﹣9.5 |
您最近一年使用:0次
2023-05-11更新
|
466次组卷
|
4卷引用:四川省峨眉第二中学校2022-2023学年高二下学期半期考试化学试题
3 . 常温下,向VmL0.1mol·L−1的MOH溶液中加入等浓度的盐酸溶液,溶液中由水电离产生的氢离子的−lgc(H+)水随加入盐酸体积的变化如图所示。下列说法正确的是(已知lg2=0.3)
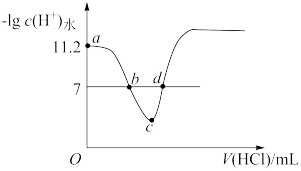

| A.常温下,0.1mol·L−1的MOH溶液溶液的电离平衡常数数量级为10-6 |
B.b点加入盐酸的体积大于 mL mL |
| C.c点溶质为MCl和HCl |
| D.d点溶液中c(M+)=c(Cl−) |
您最近一年使用:0次
名校
解题方法
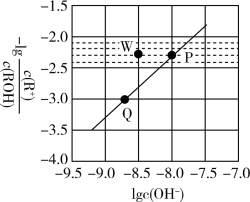
4 . 常温时,将 的
的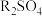 溶液(
溶液(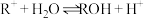 )加水稀释,溶液中
)加水稀释,溶液中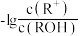 与
与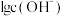 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的
的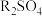 溶液(
溶液(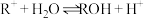 )加水稀释,溶液中
)加水稀释,溶液中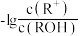 与
与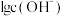 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.常温时, 的电离平衡常数为 的电离平衡常数为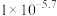 |
B.P、Q点对应的水的电离程度: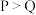 |
C.Q点对应的溶液中, |
D.常温时,加入适量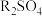 固体可使P点向W点移动 固体可使P点向W点移动 |
您最近一年使用:0次
2022-04-13更新
|
1445次组卷
|
8卷引用:四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题
四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题陕西省榆林市2022届高三第二次联考化学试题河南省大联考2022届高三第三次模拟考试理科综合化学试题湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题(已下线)化学-2022年高考押题预测卷01(全国乙卷)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)甘肃省白银市靖远县2021-2022学年高三下学期开学考试理综化学试题山西省阳泉市2022-2023学年高三上学期期末教学质量监测理科综合化学试题
名校
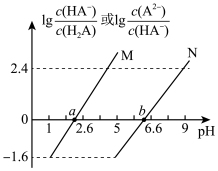
5 . 常温下将NaOH溶液滴加到 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或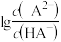 ]下列叙述错误的是
]下列叙述错误的是
 溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为
溶液中,混合溶液的pH与离子浓度变化的关系如图所示,[纵坐标为 或
或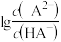 ]下列叙述错误的是
]下列叙述错误的是
A.曲线M表示pH与 的关系 的关系 |
B.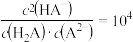 |
C.b点对应溶液中: |
| D.溶液pH从2.6到6.6的过程中,水的电离程度先增大后减小 |
您最近一年使用:0次
2021-11-19更新
|
815次组卷
|
3卷引用:四川省成都市石室中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
6 . 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3和 PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是


| A.Ksp(PbCO3)的数量级为 10-14 |
| B.相同条件下,水的电离程度 p 点大于 q 点 |
| C.L1对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 |
| D.p 点溶液中加入 Na2CO3浓溶液,可得白色沉淀 |
您最近一年使用:0次
2020-05-22更新
|
991次组卷
|
9卷引用:四川省内江市第三中学2021-2022学年高二下学期期中考试化学试题
四川省内江市第三中学2021-2022学年高二下学期期中考试化学试题广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题广东省茂名市2020届高三二模化学试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编广东省汕头市金山中学2019-2020学年高二6月月考化学试题河南省鹤壁高中2020-2021学年高二下学期第一次段考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)2021年秋季高三化学开学摸底考试卷02(山东专用)甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题
名校
7 . 已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________ ,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________ (填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________ 。用pH试纸测定该氨水pH的操作方法为_______________________________________________________ 。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________ ,25 ℃时,氨水电离平衡常数约为___________ 。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
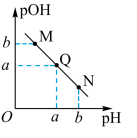
图中M、Q、N三点所示溶液呈中性的点是___________ (填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________ 。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是
您最近一年使用:0次
2019-07-22更新
|
1656次组卷
|
19卷引用:四川省宜宾市叙州区第一中学校2019-2020学年高二下学期期中考试化学试题
四川省宜宾市叙州区第一中学校2019-2020学年高二下学期期中考试化学试题2016-2017学年山东省曲阜师大附中高二上期中化学试卷山西省吕梁市岚县中学2019—2020学年高二上学期期末考试化学试题(实验班、重点班)云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题云南省陇川县民族中学2019-2020学年高二上学期期末考试化学试题云南省昭通市永善县明志高级中学2019—2020学年高二上学期期末考试化学试题贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高二上学期期末考试化学试题甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)
名校
解题方法
8 . 溶液的酸碱性可用酸度(AG)表示[AG=lg c(H+)/c(OH−) ]。室温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示,下列叙述正确的是


| A.HX、HY均为弱酸 |
| B.a点由水电离出的c(H+)=1.0×10-12mol·L-1 |
| C.c点溶液中:c(HY) <c(Na+)<c(Y-) |
| D.b点时,溶液的pH=7,酸碱恰好完全中和 |
您最近一年使用:0次
2019-03-03更新
|
403次组卷
|
2卷引用:【全国百强校】四川省成都市石室中学2018-2019学年高二上学期期中考试化学试题
2018高三上·全国·专题练习
解题方法
9 . Ⅰ.已知常温下,在NaHSO3溶液中c(H2SO3)<c( ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
(1)等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3 ⑤H2SO3溶液中水的电离程度由大到小排列顺序为____________ (填序号)。
(2)NaHSO3可以将碘盐中的KIO3还原为碘单质,试写出此反应的离子方程式:_________________________________________ 。
Ⅱ.(1)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。
(2)已知H2CO3的第二级电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列条件下所发生反应的离子方程式:
①少量Cl2通入到过量的Na2CO3溶液中:___________________________________ 。
②Cl2与Na2CO3按物质的量之比1∶1恰好反应:_______________________ 。
③少量CO2通入到过量的NaClO溶液中:_____________________________ 。
 ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:(1)等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3 ⑤H2SO3溶液中水的电离程度由大到小排列顺序为
(2)NaHSO3可以将碘盐中的KIO3还原为碘单质,试写出此反应的离子方程式:
Ⅱ.(1)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
(2)已知H2CO3的第二级电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列条件下所发生反应的离子方程式:
①少量Cl2通入到过量的Na2CO3溶液中:
②Cl2与Na2CO3按物质的量之比1∶1恰好反应:
③少量CO2通入到过量的NaClO溶液中:
您最近一年使用:0次
名校
10 . 25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是
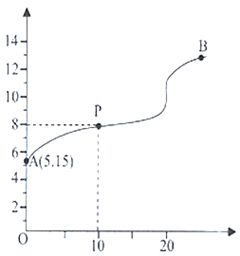

| A.HX的电离常数Ka的数量级为10-10 |
| B.P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
| C.滴定过程中可选用的指示剂有甲基橙和酚酞 |
| D.A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变 |
您最近一年使用:0次
2018-05-20更新
|
947次组卷
|
5卷引用:四川省眉山市仁寿第一中学北校区2019-2020学年高二下学期6月月考(期中)理综化学试题



