名校
1 .  为二元弱酸,常温下将
为二元弱酸,常温下将 的NaOH溶液滴入20mL
的NaOH溶液滴入20mL 的NaHA溶液中,溶液中
的NaHA溶液中,溶液中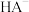 (或
(或 )的分布系数
)的分布系数 、加入NaOH溶液的体积V与pH的关系如图所示[已知:
、加入NaOH溶液的体积V与pH的关系如图所示[已知: ]。下列叙述正确的是
]。下列叙述正确的是
 为二元弱酸,常温下将
为二元弱酸,常温下将 的NaOH溶液滴入20mL
的NaOH溶液滴入20mL 的NaHA溶液中,溶液中
的NaHA溶液中,溶液中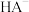 (或
(或 )的分布系数
)的分布系数 、加入NaOH溶液的体积V与pH的关系如图所示[已知:
、加入NaOH溶液的体积V与pH的关系如图所示[已知: ]。下列叙述正确的是
]。下列叙述正确的是
| A.到达m点需要加入NaOH溶液的体积大于10mL |
B.q点溶液中溶质的第一步水解平衡常数的数量级为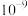 |
| C.随着NaOH溶液的加入,水的电离程度一直在增大 |
D.n点满足关系: |
您最近一年使用:0次
2 . 向10mLHCOOH-NH4Cl混合溶液(浓度均为0.1mol·L−1)中滴加0.1mol·L−1NaOH溶液,并监测溶液pH变化,实验数据如图。由该实验可得到的结论是
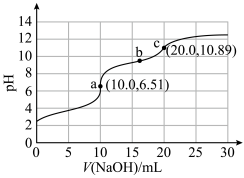
| A.HCOOH电离方程式为HCOOH=H++HCOO− |
| B.由a点数据可推出电离能力:HCOOH>NH3·H2O |
| C.b点溶液中的OH−主要来自HCOO−水解 |
| D.0.05mol·L−1氨水的pH<10.89 |
您最近一年使用:0次
2024-04-13更新
|
479次组卷
|
3卷引用:湖南省衡阳县第四中学2023-2024学年高三下学期4月月考化学试题
名校
解题方法
3 . 常温下,向20mL0.1mol/L一元碱MOH溶液中滴加等浓度的一元酸HX溶液,滴定过程中溶液pH值的变化曲线如下图所示,已知4<m<6,下列说法不正确的是

| A.该滴定过程中应选用酚酞作指示剂 | B.一元酸HX的Ka=5×10-5 |
| C.溶液中水的电离程度:b>c>a | D.c点溶液中:c(M+)>c(X-)>c(H+)>c(OH-) |
您最近一年使用:0次
2024-01-15更新
|
340次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题
湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)广东省梅州市大埔县虎山中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 25℃时,等体积两种一元酸HA和HB分别用等浓度的 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是
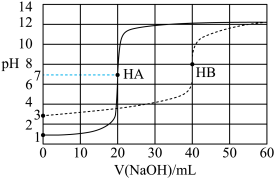
 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是
| A.酸性:HA<HB |
| B.酸HB的电离度约为0.5% |
C.起始浓度: , , |
D.用 溶液滴定HB可用甲基橙作指示剂 溶液滴定HB可用甲基橙作指示剂 |
您最近一年使用:0次
2023-10-28更新
|
1197次组卷
|
8卷引用:湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题
5 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究葡萄糖的还原性 | 在一支试管中先加入2mL10%NaOH溶液,滴入5滴 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 |
B | 探究过氧化氢能否将亚硫酸盐氧化 | 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,观察是否产生白色沉淀 |
C | 验证草酸为二元弱酸 | 用0.1mol/LNaOH标准溶液滴定等浓度草酸溶液,使用酚酞作指示剂,到达滴定终点时消耗NaOH的体积为草酸的2倍 |
D | 探究水解程度: | 用pH计分别测定饱和 和 和 溶液的pH,前者pH大 溶液的pH,前者pH大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 某水样中含一定浓度的 和其它不与酸碱反应的离子。取
和其它不与酸碱反应的离子。取 水样,用
水样,用 盐酸进行滴定,溶液
盐酸进行滴定,溶液 随滴加盐酸体积
随滴加盐酸体积 的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
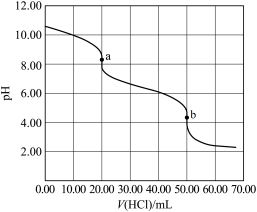
 和其它不与酸碱反应的离子。取
和其它不与酸碱反应的离子。取 水样,用
水样,用 盐酸进行滴定,溶液
盐酸进行滴定,溶液 随滴加盐酸体积
随滴加盐酸体积 的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
A.该水样中 |
B.在整个滴定过程中可能存在以下等量关系 |
C.滴加盐酸 过程中,溶液中 过程中,溶液中 明显增大 明显增大 |
| D.滴定分析时,a点可使用甲基橙作指示剂指示滴定终点 |
您最近一年使用:0次
名校
7 . 电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用 盐酸标准溶液测定xmL某纯碱样品溶液中
盐酸标准溶液测定xmL某纯碱样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是

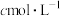 盐酸标准溶液测定xmL某纯碱样品溶液中
盐酸标准溶液测定xmL某纯碱样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
A.水的电离程度: |
B.a点溶液中: ,c点溶液中滴入2滴甲基橙溶液一定变黄色 ,c点溶液中滴入2滴甲基橙溶液一定变黄色 |
C.xmL该纯碱样品溶液中含有 的质量为0.084cg 的质量为0.084cg |
D.b到c过程中存在 |
您最近一年使用:0次
名校
解题方法
8 . 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用 的NaOH标准溶液滴定同浓度的
的NaOH标准溶液滴定同浓度的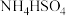 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知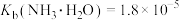 。下列说法错误的是
。下列说法错误的是

 的NaOH标准溶液滴定同浓度的
的NaOH标准溶液滴定同浓度的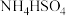 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。已知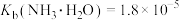 。下列说法错误的是
。下列说法错误的是
A.a点溶液中 |
B.b点溶液中 |
C.常温时,c点溶液中 |
D.b、d点水的电离程度: |
您最近一年使用:0次
2023-03-08更新
|
500次组卷
|
5卷引用:湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题
湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题湖南省邵阳市邵东市2022-2023学年高三下学期3月月考化学试题山东省曹县第一中学2022-2023学年高三下学期2月月考化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)(已下线)专题8 新概念应用
名校
9 . 氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之),也是分析化学中常用的分析手段。
I.用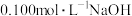 溶液滴定
溶液滴定 浓度约为0.100mol/L
浓度约为0.100mol/L 溶液。
溶液。
(1)该酸碱中和滴定实验最好选用_______ (填标号)作指示剂。
A.酚酞 B.石蕊 C.甲基橙
(2)实验所用仪器如下图所示。仪器A盛装_______ (填“ ”或“
”或“ ”)溶液。
”)溶液。

(3)若滴定开始和结束时,盛装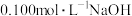 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为_______  。
。

II.用氧化还原滴定方法测定粗品中 的质量分数。
的质量分数。
实验步骤:称取 粗品配制
粗品配制 的溶液待用。用酸式滴定管取
的溶液待用。用酸式滴定管取 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液
溶液 。回答下列问题:
。回答下列问题:
(4)向 溶液中加入过量的
溶液中加入过量的 溶液并酸化,
溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(5)用 溶液滴定至终点的现象为
溶液滴定至终点的现象为_______ 。
(6)粗品中 的质量分数为
的质量分数为_______ 。
(7)若在取 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果_______ (填“偏高”“偏低”或“不变”)
I.用
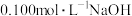 溶液滴定
溶液滴定 浓度约为0.100mol/L
浓度约为0.100mol/L 溶液。
溶液。(1)该酸碱中和滴定实验最好选用
A.酚酞 B.石蕊 C.甲基橙
(2)实验所用仪器如下图所示。仪器A盛装
 ”或“
”或“ ”)溶液。
”)溶液。
(3)若滴定开始和结束时,盛装
 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为 。
。
II.用氧化还原滴定方法测定粗品中
 的质量分数。
的质量分数。实验步骤:称取
 粗品配制
粗品配制 的溶液待用。用酸式滴定管取
的溶液待用。用酸式滴定管取 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液
溶液 。回答下列问题:
。回答下列问题:(4)向
 溶液中加入过量的
溶液中加入过量的 溶液并酸化,
溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)用
 溶液滴定至终点的现象为
溶液滴定至终点的现象为(6)粗品中
 的质量分数为
的质量分数为(7)若在取
 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果
您最近一年使用:0次
2023-02-06更新
|
401次组卷
|
3卷引用:湖南省长沙市第一中学2022-2023学年高二下学期入学考试化学试题
名校
解题方法
10 . I.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂(指示剂加在待测液中)。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ,直到_______ ,停止滴定。
(2)下列操作中可能使所测NaOH溶液的浓度偏高的是_______(填字母)。
(3)用0.1000mol/LNaOH溶液分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:

滴定醋酸的曲线是_______ (填“I”或“II”),V1_______ V2。(填“>”“<”或“=”)
II.氧化还原滴定实验同中和滴定类似。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在500mg•L-1左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告
i.测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然
ii.测定原理:C6H8O6+I2=C6H6O6+2H++2I-
iii.实验过程:
①移取20.00mL饮料样品于250mL锥形瓶中,加入50mL蒸馏水,2mL指示剂
②在滴定管中装入7.50×10-3mol·L-1标准碘溶液,滴定至终点,读取并记录相关数据
③重复测定3次,数据记录如下表
(4)回答下列问题:
①实验选择选用_______ 作指示剂
②计算该饮料样品中维生素C含量为_______ mg•L-1.该饮料_______ (填“是”或“不是”)鲜榨橙汁。(已知维生素C的摩尔质量为176g/mol)
③滴定时不能剧烈摇动锥形瓶原因是_______ 。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测NaOH溶液的浓度偏高的是_______(填字母)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸溶液体积时,开始仰视读数,滴定结束时俯视读数 |

滴定醋酸的曲线是
II.氧化还原滴定实验同中和滴定类似。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,新鲜橙汁中维生素C的含量在500mg•L-1左右。某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。下面是测定实验分析报告
i.测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然
ii.测定原理:C6H8O6+I2=C6H6O6+2H++2I-
iii.实验过程:
①移取20.00mL饮料样品于250mL锥形瓶中,加入50mL蒸馏水,2mL指示剂
②在滴定管中装入7.50×10-3mol·L-1标准碘溶液,滴定至终点,读取并记录相关数据
③重复测定3次,数据记录如下表
| 第一次 | 第二次 | 第三次 | |
| 滴定前读数/mL | 0.00 | 0.44 | 1.33 |
| 滴定后读数/mL | 15.01 | 15.44 | 15.32 |
①实验选择选用
②计算该饮料样品中维生素C含量为
③滴定时不能剧烈摇动锥形瓶原因是
您最近一年使用:0次
2023-02-02更新
|
155次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题



