1 . 已知部分弱酸的电离平衡常数如下表:
下列离子方程式正确的是
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | 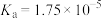 | 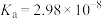 | 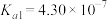 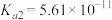 | 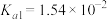  |
A.少量 通入NaClO溶液中: 通入NaClO溶液中: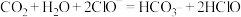 |
B.少量的 通入 通入 溶液中: 溶液中: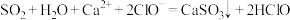 |
C.少量的 通入 通入 溶液中: 溶液中: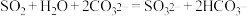 |
D.相同浓度 溶液与 溶液与 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
2021-12-17更新
|
282次组卷
|
36卷引用:辽宁省辽阳市集美中学2020届高二12月月考化学试题
辽宁省辽阳市集美中学2020届高二12月月考化学试题辽宁省瓦房店市实验高级中学2019-2020学年高二上学期第三次月考化学试题2016届浙江省温州市高三上学期返校联考化学试卷2016届浙江省严州中学新安江校区高三上学期第二次模拟化学试卷河北省大名县第一中学2018届高三(实验班)上学期第一次月考化学试题湖南省长沙市长郡中学2018届高三月考化学试题安徽省滁州市民办高中2017-2018学年高二下学期第一次联考化学试题福建省泉州市泉港第一中学2019届高三上学期期末质量检测理科综合化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题福建省龙海市第二中学2019届高三下学期期初考试化学试题【全国百强校】河北省武邑中学2018-2019学年高二下学期第一次月考化学试题山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )湖南省长沙市第一中学2019-2020学年高二上学期第三次月考化学试题江西省赣州市宁师中学2019-2020学年高二12月月考化学试题福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题安徽省泗县第一中学2019-2020学年高二下学期第四次月考化学试题浙江省宁波市余姚中学2019-2020学年高二下学期期中考试化学试题(已下线)3.1+弱电解质的电离-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 作业帮内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题(已下线)3.1 弱电解质的电离(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)【浙江新东方】高中化学20210304-010浙江省宁波市慈溪市2020-2021学年高二下学期期末测试化学试题宁夏银川一中2021-2022学年高二上学期期中考试化学试题安徽省芜湖市第一中学2021-2022学年高二上学期第二次月末诊断测试化学试题黑龙江省哈尔滨市第九中学校2021-2022学年高二上学期期中学业阶段性评价考试化学(理)试题武汉市第六中学2022-2023学年高二上学期第二次月考化学试题安徽省马鞍山市第二中学2022-2023学年高二上学期11月期中考试化学试题北京市第五十中学2022-2023学年高二上学期期中考试化学试题安徽省芜湖市第一中学2023-2024学年高二上学期12月份教学质量诊断测试化学试题安徽省桐城中学2023-2024学年高二上学期第二次教学质量检测化学试题河北省邯郸市永年区第二中学2023-2024学年高二上学期12月月考化学试题河北省保定市定州市第二中学2023-2024学年高二上学期2月期末化学试题
2021·全国·模拟预测
名校
解题方法
2 . 柠檬酸是天然防腐剂和食品添加剂,它是一种有机三元弱酸,与NaOH溶液反应生成柠檬酸钠(用Na3Y表示)。下列说法正确的是
A.柠檬酸的电离方程式为:H3Y 3H++Y3- 3H++Y3- |
| B.NaH2Y水溶液中:c(H2Y-) < c(Na+) |
| C.Na3Y水溶液中: c(Na+) + c(H+) = 3c(Y3- )+c(OH- ) |
| D.Na3Y水溶液的 pH值随着c(Na3Y)的增大而减小 |
您最近一年使用:0次
2021-09-30更新
|
1302次组卷
|
11卷引用:辽宁省辽东南协作体2021-2022学年高二上学期期中考试化学试题
辽宁省辽东南协作体2021-2022学年高二上学期期中考试化学试题(已下线)第7周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二10月月考化学试题2021年广东省高考化学试卷变式题1-10题广东省汕头市2021—2022学年普通高中高二下学期期末教学质量检测化学试题广东省珠海市实验中学、东莞市第六高级中学、河源高级中学、中山市实验中学2021-2022学年下学期高三第五次联考化学试题广东省广州中学2022-2023学年高二上学期期末考试化学试题广东省深圳市福田区福田中学2022-2023学年高三下学期3月月考化学试题广东省佛山市南海区2022届高三上学期8月摸底测试化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题
解题方法
3 . 下列说法错误的是
①强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子
②氨气溶于水,当NH3•H2O电离出的c(OH-)=c( )时,表明NH3•H2O电离处于平衡状态
)时,表明NH3•H2O电离处于平衡状态
③室温下,由0.1mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH=B++OH-
④电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大
⑤稀释弱电解质溶液时,所有粒子浓度都一定会减小
⑥室温下,0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液中水的电离程度相同
⑦25℃和60℃的水的pH,前者大于后者,但都显中性
①强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子
②氨气溶于水,当NH3•H2O电离出的c(OH-)=c(
 )时,表明NH3•H2O电离处于平衡状态
)时,表明NH3•H2O电离处于平衡状态③室温下,由0.1mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH=B++OH-
④电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大
⑤稀释弱电解质溶液时,所有粒子浓度都一定会减小
⑥室温下,0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液中水的电离程度相同
⑦25℃和60℃的水的pH,前者大于后者,但都显中性
| A.①②③④ | B.②③④⑤ | C.②④⑤⑥ | D.④⑤⑥⑦ |
您最近一年使用:0次
名校
解题方法
4 . 下列方程式书写正确的是
A.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++ |
B.S2-的水解方程式:S2-+2H2O H2S+2OH- H2S+2OH- |
C. 的水解方程式: 的水解方程式: +H+ +H+ H2O+CO2 H2O+CO2 |
D.BaSO4的沉淀溶解平衡:BaSO4(s) Ba2+(aq)+ Ba2+(aq)+  (aq) (aq) |
您最近一年使用:0次
2020-12-27更新
|
216次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
5 . 在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4③ 0.1mol/L NH4HSO4 ④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是__________________ (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是________ ;c(NH )最小的是
)最小的是________ ﹝填序号﹞
(3)比较溶液②、③中c(NH )的大小关系是②
)的大小关系是②_______ ③ ﹝填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度____ NH 的水解程度(填“>”、“<”或“=”),
的水解程度(填“>”、“<”或“=”),
(1)溶液①呈酸性,其原因是
(2)在上述五种溶液中,pH最小的是
 )最小的是
)最小的是(3)比较溶液②、③中c(NH
 )的大小关系是②
)的大小关系是②(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
 的水解程度(填“>”、“<”或“=”),
的水解程度(填“>”、“<”或“=”),
您最近一年使用:0次
2020-11-23更新
|
278次组卷
|
3卷引用:辽宁省恒仁满族自治县第二高级中学2020-2021学年高二上学期期末考试化学试题
解题方法
6 . 下列反应不属于水解反应或水解方程式不正确的是
①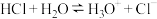
②
③
④碳酸氢钠溶液: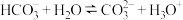
⑤ 溶于
溶于 中:
中: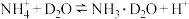
①
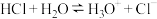
②

③

④碳酸氢钠溶液:
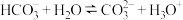
⑤
 溶于
溶于 中:
中: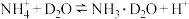
| A.①②③④ | B.①②③ | C.②③⑤ | D.全部 |
您最近一年使用:0次
2020-11-19更新
|
538次组卷
|
4卷引用:辽宁省六校协作体2020-2021学年高二上学期期中联考化学试题
名校
解题方法
7 . 下列方程式书写正确的是( )
A.HCO 在水溶液中的电离方程式:HCO 在水溶液中的电离方程式:HCO +H2O +H2O H3O++CO H3O++CO |
B.H2SO3的电离方程式H2SO3 2H++SO 2H++SO |
C.CO 的水解方程式:CO 的水解方程式:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
D.CaCO3的电离方程式:CaCO3 Ca2++CO Ca2++CO |
您最近一年使用:0次
2020-09-18更新
|
153次组卷
|
5卷引用:辽宁省沈阳市第二十八中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 下列解释事实的化学用语错误的是
| A.闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+=CuS + Zn2+ |
B.0.1 mol/L 的醋酸溶液pH约为3:CH3COOH  CH3COO- + H+ CH3COO- + H+ |
| C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e-=H2↑+ 2OH- |
| D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e-= Fe3+ |
您最近一年使用:0次
2020-05-01更新
|
262次组卷
|
11卷引用:辽宁省辽河油田第二高级中学2020届高三期末考试化学试题
辽宁省辽河油田第二高级中学2020届高三期末考试化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题湖北省示范高中2019~2020学年高三11月月考理综化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——难容电解质的沉淀溶解平衡2020届高三《新题速递·化学》12月第02期(考点01-06)山东省济宁市嘉祥县第一中学2020届高三下学期第三次质量检测化学试题山东省2020届高三模拟考试化学试题(已下线)考点04 离子反应-2020年高考化学命题预测与模拟试题分类精编山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题山东省济宁市泗水县2021届高三上学期期中考试化学试题北京市中国人民大学附属中学朝阳学校2021-2022学年高三上学期第一次月考化学试题
9 . 用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________ 种。
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_____________________ ,所含官能团的名称为 __________

(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________ ;
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为_________________ 。
(5)已知常温时CH3COOH⇌CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O⇌CH3COOH + OH–的平衡常数Kh=________________ 。
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序_________________________ ,列出质子守恒关系式_____________________
(1)C4H10的一氯代物有
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为

(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为
(5)已知常温时CH3COOH⇌CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O⇌CH3COOH + OH–的平衡常数Kh=
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序
您最近一年使用:0次
2020-04-24更新
|
295次组卷
|
2卷引用:辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题
10 . 下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
| B.乙烷燃烧热的热化学方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol |
C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq) |
您最近一年使用:0次



