名校
解题方法
1 . 在水的电离平衡中, 和
和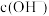 的关系如下图所示:
的关系如下图所示:
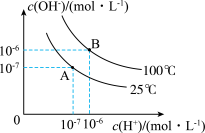
(1)B点水的离子积为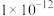 ,A点水的离子积为
,A点水的离子积为_____ ,造成水的离子积变化的原因是_____ 。
(2) 时,
时,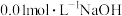 溶液的
溶液的
_____ 。
(3) 时,
时, 在水溶液中的电离方程式为
在水溶液中的电离方程式为 ;
; 。
。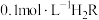 溶液的
溶液的
_____ 1(填“>”“<”或“=”)。
 和
和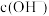 的关系如下图所示:
的关系如下图所示:
(1)B点水的离子积为
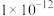 ,A点水的离子积为
,A点水的离子积为(2)
 时,
时,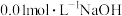 溶液的
溶液的
(3)
 时,
时, 在水溶液中的电离方程式为
在水溶液中的电离方程式为 ;
; 。
。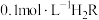 溶液的
溶液的
您最近一年使用:0次
名校
2 . 下列电离方程式错误的是
A. 溶于水: 溶于水: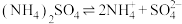 |
B. 溶于水: 溶于水: |
C. 溶于水: 溶于水: |
D. 溶于水: 溶于水: , , |
您最近一年使用:0次
3 . 下列物质在水中的电离方程式正确的是
A.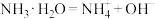 | B.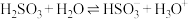 |
C. | D. |
您最近一年使用:0次
2023-11-30更新
|
145次组卷
|
2卷引用:辽宁省抚顺市六校2023-2024学年高二上学期期中考试化学试题
解题方法
4 . 下列电离方程式中正确的是
A.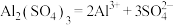 | B. |
C.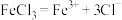 | D. |
您最近一年使用:0次
名校
解题方法
5 . 下列离子方程式改写成化学方程式正确的是
| A.CH3COOH+OH-=CH3COO-+H2O、CH3COOH+KOH=CH3COOK+H2O |
| B.Cu2++2OH-=Cu(OH)2↓、CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
C.SO2+2OH-= +H2O、SO2+Ba(OH)2=BaSO3↓+H2O +H2O、SO2+Ba(OH)2=BaSO3↓+H2O |
D. +2H+=CO2↑+H2O、CaCO3+2HC1=CaC12+CO2↑+H2O +2H+=CO2↑+H2O、CaCO3+2HC1=CaC12+CO2↑+H2O |
您最近一年使用:0次
2023-08-26更新
|
0次组卷
|
3卷引用:辽宁省大连市第八中学2022-2023学年高一上学期10月月考化学试题
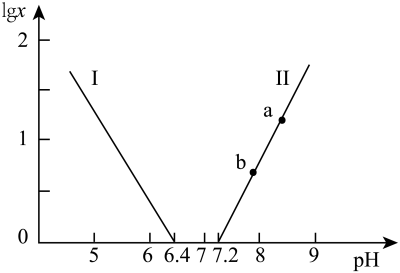
6 . 常温下,水溶液中部分缓冲对的微粒浓度之比的对数值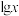 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
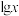 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
A.曲线Ⅰ表示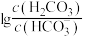 与溶液pH的变化关系 与溶液pH的变化关系 |
B.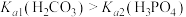 |
| C.a→b的过程中,水的电离程度逐渐减小 |
D.当pH增大时,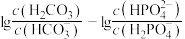 的值逐渐增大 的值逐渐增大 |
您最近一年使用:0次
名校
7 . 下列表达式书写正确的是
A. 在水溶液中的电离方程式: 在水溶液中的电离方程式: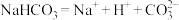 |
B. 的电离方程式: 的电离方程式: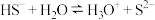 |
C. 的水解方程式: 的水解方程式: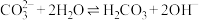 |
D. 的水解方程式: 的水解方程式: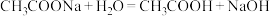 |
您最近一年使用:0次
8 . 室温下,向0.01mol·L-1的CH3COOH溶液中不断加水稀释,其溶液的pH变化如图所示[已知:Ka(CH3COOH)=1.6×10-5,lg2=0.3,电离度= ×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是

 ×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
| A.x点的pH为3.2 |
| B.x点与y点CH3COOH的电离平衡常数:Kx>Ky |
| C.室温下,0.01mol·L-1的CH3COOH溶液中,CH3COOH的电离度约为4% |
| D.升高温度,c(H+)增大,Ka的大小保持不变 |
您最近一年使用:0次
2022-09-02更新
|
490次组卷
|
3卷引用:辽宁省葫芦岛市协作校2021-2022学年高二上学期第二次考试化学试题
解题方法
9 . 下列与事实对应的化学用语正确的是
A. 元素的非金属性强于I元素: 元素的非金属性强于I元素: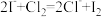 |
B.C原子和O原子形成 的过程: 的过程: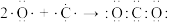 |
C. 溶液的 溶液的 为3: 为3: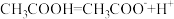 |
D.用石墨电极电解 溶液: 溶液: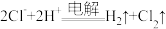 |
您最近一年使用:0次
解题方法
10 . 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________ 。
②0.01 mol·L-1的NH3·H2O的pH=___________ 。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________ (填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________ 。
(2)甲酸钠(HCOONa)属于_______ (填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是_________ (用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______ mol·L-1。
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为
②0.01 mol·L-1的NH3·H2O的pH=
③若上述酸和碱等体积充分混合,混合后所得溶液的pH
(2)甲酸钠(HCOONa)属于
您最近一年使用:0次
2022-01-10更新
|
491次组卷
|
7卷引用:辽宁省葫芦岛市协作校2021-2022学年高三上学期第二次联考化学试题
辽宁省葫芦岛市协作校2021-2022学年高三上学期第二次联考化学试题湖南省百所名校大联考2021-2022学年高二上学期期中考试化学试题河北金太阳2021-2022学年高二上学期期中联考化学试题重庆市九校联盟2021-2022学年高二上学期12月联考化学试题陕西省榆林市2021-2022学年高二上学期期末考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题



