名校
1 . 硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:
(1)①某温度(t℃)时,水的离子积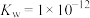 ,则t℃
,则t℃___________ 25℃(填“>”“<”或“=”)。此温度下,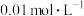 的氨水中
的氨水中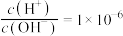 ,则该氨水溶液的pH=
,则该氨水溶液的pH=___________ ;
②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则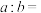
___________ 。
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
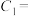
___________ ,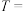
___________ 。
②该实验中通过观察___________ 实验现象判断反应的快慢。为此,该实验中三种溶液混合的顺序不合理的是___________ 。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中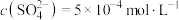 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中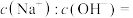
___________ 。
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
(1)①某温度(t℃)时,水的离子积
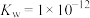 ,则t℃
,则t℃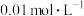 的氨水中
的氨水中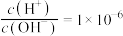 ,则该氨水溶液的pH=
,则该氨水溶液的pH=②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则
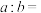
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
| 实验编号 | T/K |  | 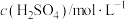 | 实验目的 |
| I | 298 | 1 | 0.1 | 实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响 |
| II | 308 |  |  | |
| III | T | 1 | 0.2 |
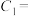
②该实验中通过观察
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中
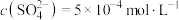 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中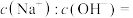
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
| A.水的电离程度 | B. |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中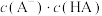 的值 的值 |
您最近一年使用:0次
名校
2 . 下列实验操作或做法正确且能达到目的的是
| 选项 | 实验操作或实验做法 | 实验目的 |
| A | 将过量 通入溴水中,溴水褪色 通入溴水中,溴水褪色 | 证明 具有漂白性 具有漂白性 |
| B | 向 溶液中通入少量的 溶液中通入少量的 生成白色沉淀 生成白色沉淀 | 证明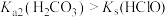 |
| C | 向盛有2  溶液的试管中滴加浓的维生素C溶液,观察颜色变化 溶液的试管中滴加浓的维生素C溶液,观察颜色变化 | 探究维生素C的还原性 |
| D | 向2支盛有5 不同浓度 不同浓度 溶液的试管中同时加入2 溶液的试管中同时加入2 0.2 0.2  溶液,观察实验现象 溶液,观察实验现象 | 探究浓度对化学反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
244次组卷
|
4卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题
山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题黑龙江省海伦市第一中学2022-2023学期高三上学期期中考试化学试卷题(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
3 . 为实现相关实验目的,选用的试剂、装置和操作均合理的是
| 实验目的 | 实验内容 | |
| A | 证明氨水中存在一水合氨的电离平衡 | 向含有酚酞的氨水中加入少量NaOH固体 |
| B | 配制100mL1.0 mol • L-1 NaOH 溶液 | 向100 mL容量瓶中加入4. 0 g NaOH固体,加水到刻度线 |
| C | 模拟利用牺牲阳极的阴极保护法保护铁 | 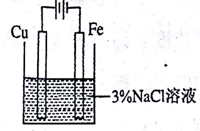 |
| D | 比较Cl-和I-的还原性 | 将少量Cl2通入滴有淀粉溶液的KI溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 填空
(1)25℃时,亚碲酸( )的
)的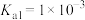 ,
,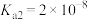 。常温下,
。常温下, 溶液的pH
溶液的pH______ (填“<”“>”或“=”)7。
(2)已知25℃时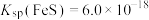 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[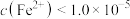 mol⋅L
mol⋅L ],则需控制溶液中
],则需控制溶液中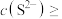
______ 。
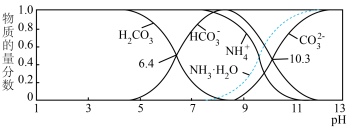
(3)室温下,测得用氨水吸收 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中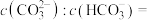
______ (已知) )。
)。
(4)若向浓烧碱溶液中通入 气体,使所得溶液
气体,使所得溶液 ,则此时溶液中的
,则此时溶液中的
______ mol⋅L (室温下,
(室温下, 的
的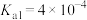 ,
,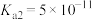 )。
)。
(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数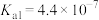 ,
, ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中
______ (填“>”“<”或“=”) 。
。
(6) 是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出 和
和 反应的化学方程式:
反应的化学方程式:____________ 。
②利用 制备无水
制备无水 时,可用
时,可用 和
和 混合共热,试解释原因:
混合共热,试解释原因:____________ 。
(1)25℃时,亚碲酸(
 )的
)的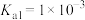 ,
,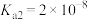 。常温下,
。常温下, 溶液的pH
溶液的pH(2)已知25℃时
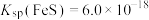 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[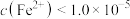 mol⋅L
mol⋅L ],则需控制溶液中
],则需控制溶液中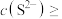
(3)室温下,测得用氨水吸收
 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中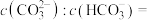
 )。
)。
(4)若向浓烧碱溶液中通入
 气体,使所得溶液
气体,使所得溶液 ,则此时溶液中的
,则此时溶液中的
 (室温下,
(室温下, 的
的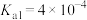 ,
,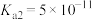 )。
)。(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体
 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数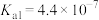 ,
, ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中
 。
。(6)
 是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。①根据实验现象写出
 和
和 反应的化学方程式:
反应的化学方程式:②利用
 制备无水
制备无水 时,可用
时,可用 和
和 混合共热,试解释原因:
混合共热,试解释原因:
您最近一年使用:0次
5 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12668次组卷
|
13卷引用:山东省枣庄市第三中学2022届高三第一次月考化学试题
山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记青海省湟川中学2020-2021学年高二下学期第一次月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
名校
6 . 一氯化碘(沸点97.4℃),是一种红棕色易挥发的液体,不溶于水,易溶于乙醇和乙酸。某校研究性学习小组的同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:

回答下列问题:
(1)ICl中I元素化合价为___________ 。
(2)各装置连接顺序为a→_________________________ ;
如何检验A装置的气密性:_________________________________________________ 。
(3)B装置烧瓶需放在冷水中,其目的是:__________________________ ;D装置中溶质如果改用Na2CO3溶液。发生反应的离子方程式为___________________________ 。
(已知电离平衡常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8)
(4)将B装置得到的液态产物进一步提纯可得到较纯净的ICl,提纯采取的操作方法是____ 。
(5)测定ICl的纯度。实验过程如下(设杂质不参与反应):
步骤1:称取4.00 g ICl与冰醋酸配成500 mL标准液。
步骤2:取上述标准液25.00 mL于锥形瓶中,加入足量KI溶液、100 mL蒸馏水,滴入几滴_________ 作指示剂(填名称),用0.1000 mol•L-1 Na2S2O3溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6),滴定到终点时消耗Na2S2O3溶液24.00 mL。
①步骤1配制标准液需要的玻璃仪器除烧杯、量筒及玻璃棒外,还需要_________ (填仪器名称)。
②ICl的纯度是_________________________________________ 。(列式并计算)

回答下列问题:
(1)ICl中I元素化合价为
(2)各装置连接顺序为a→
如何检验A装置的气密性:
(3)B装置烧瓶需放在冷水中,其目的是:
(已知电离平衡常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8)
(4)将B装置得到的液态产物进一步提纯可得到较纯净的ICl,提纯采取的操作方法是
(5)测定ICl的纯度。实验过程如下(设杂质不参与反应):
步骤1:称取4.00 g ICl与冰醋酸配成500 mL标准液。
步骤2:取上述标准液25.00 mL于锥形瓶中,加入足量KI溶液、100 mL蒸馏水,滴入几滴
①步骤1配制标准液需要的玻璃仪器除烧杯、量筒及玻璃棒外,还需要
②ICl的纯度是
您最近一年使用:0次
2017-06-03更新
|
642次组卷
|
3卷引用:山东省青岛市第二中学2022-2023学年高二上学期期末考试化学试题
7 . 以NaClO为有效成分的“84”消毒液在抗击新冠疫情的消杀工作中起到了重要作用。某研究小组设计下列实验探究NaClO的性质。(已知电离常数:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:Ka=2.9×10-8)
结合上述实验探究,预测的现象以及解释均正确的是
| 实验 | 装置 | 试剂(少量) | 预测可能的现象 |
| ① |  | 酚酞 | 无色溶液最终呈红色 |
| ② | CO2 | 无明显现象 | |
| ③ | 淀粉-KI溶液+稀硫酸 | 无色溶液立即变蓝 | |
| ④ | FeCl3溶液 | 溶液略呈浅绿色 |
| A.实验①:NaClO溶液呈碱性:ClO-+H2O⇌HClO+OH- |
B.实验②:NaClO可用于制得HClO:ClO-+CO2+H2O=2HClO+ |
| C.实验③:NaClO具有氧化性ClO-+2I-+2H+=Cl-+I2+H2O |
D.实验④:NaClO具有还原性:ClO-+4Fe3++2H2O= +4Fe2++4H+ +4Fe2++4H+ |
您最近一年使用:0次
2020-07-11更新
|
388次组卷
|
4卷引用:山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题
山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题辽宁省大连市2020届高三第二次模拟考试理科综合化学试题天津市南开区2020届高三第二次模拟考试化学试题(已下线)微专题21 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2022年高考化学考点微专题



