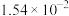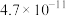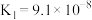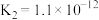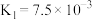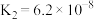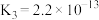1 . 电解质的溶液中存在着众多的化学平衡。已知室温下,电离平衡常数如下表
(1)室温下,有浓度均为 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH由大到小 的顺序为___________ (填序号)。比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③___________ ④(填“<”、“=”或“>”)。为确定溶液①稀释后的精确浓度,取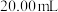 待测溶液①于锥形瓶中,用浓度为
待测溶液①于锥形瓶中,用浓度为 的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为
的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为___________ ,达到滴定终点的现象为___________ 。在滴定实验过程中,下列仪器中有蒸馏水,对实验结果没有影响的是___________ (“滴定管”或“锥形瓶”)。经3次平行实验,达到滴定终点时,消耗氢氧化钠标准溶液体积的平均值为 ,则①所得溶液的准确浓度为
,则①所得溶液的准确浓度为___________  。
。
(2)根据以上的电离平衡常数,判断下列说法正确的是___________。
(3)根据以上的电离平衡常数,25℃时,浓度均为 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
___________ (填“>”“<”或“=”) 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可___________ (填序号)。
A.向 溶液中加适量水 B.向
溶液中加适量水 B.向 溶液中加适量NaOH固体
溶液中加适量NaOH固体
C.向 溶液中加
溶液中加 固体 D.向
固体 D.向 溶液中加适量的水
溶液中加适量的水
(4)草酸 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入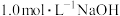 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为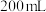 。测得溶液中微粒的
。测得溶液中微粒的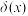 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。

①当加入NaOH溶液的体积为 时,
时,
___________ (写关系式)。
②c点,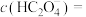
___________  。
。
物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| —— | —— | —— |
 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH 的物质的量浓度:③
的物质的量浓度:③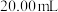 待测溶液①于锥形瓶中,用浓度为
待测溶液①于锥形瓶中,用浓度为 的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为
的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为 ,则①所得溶液的准确浓度为
,则①所得溶液的准确浓度为 。
。(2)根据以上的电离平衡常数,判断下列说法正确的是___________。
A.相同条件下,同浓度的 溶液和 溶液和 溶液的碱性,前者更强 溶液的碱性,前者更强 |
B. 溶液中通入少量 溶液中通入少量 : : |
C. 溶液中通入少量 溶液中通入少量 : :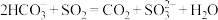 |
D.向氯水中分别加入等浓度的 和 和 溶液,均可提高氯水中 溶液,均可提高氯水中 的浓度 的浓度 |
 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可A.向
 溶液中加适量水 B.向
溶液中加适量水 B.向 溶液中加适量NaOH固体
溶液中加适量NaOH固体C.向
 溶液中加
溶液中加 固体 D.向
固体 D.向 溶液中加适量的水
溶液中加适量的水(4)草酸
 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入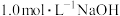 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为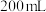 。测得溶液中微粒的
。测得溶液中微粒的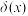 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。
①当加入NaOH溶液的体积为
 时,
时,
②c点,
 。
。
您最近一年使用:0次
2 . 毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如图:
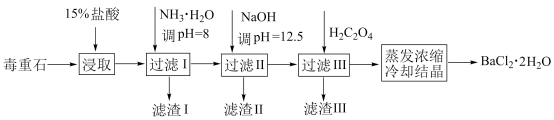
(1)写出“浸取”环节发生的主要反应的离子方程式:____ 。
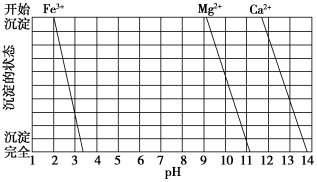
(2)如图是一些难溶氢氧化物在不同pH下的沉淀溶解图:
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
①滤渣I中含____ (填化学式)。再加入NaOH调节pH=12.5可除去___ (填离子符号)。
②加入H2C2O4应避免过量的原因是____ 。
(3)25℃,H2C2O4和HF两种酸的电离平衡常数如表:
H2C2O4溶液和NaF溶液反应的离子方程式为____ 。

(1)写出“浸取”环节发生的主要反应的离子方程式:
(2)如图是一些难溶氢氧化物在不同pH下的沉淀溶解图:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
①滤渣I中含
②加入H2C2O4应避免过量的原因是
| H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.31×10-4 |
H2C2O4溶液和NaF溶液反应的离子方程式为
您最近一年使用:0次
名校
3 . 下表是几种弱酸常温下的电离平衡常数:
则下列说法中不正确的是
|
|
|
|
|
|
|
|
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释醋酸, 增大 增大 |
| D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变 |
您最近一年使用:0次
2021-12-02更新
|
414次组卷
|
21卷引用:福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题
福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题河北省邯郸市永年县第二中学2017-2018学年高二10月月考化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题黑龙江省大庆铁人中学2019-2020学年高二10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——弱电解质的电离四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题(已下线)3.1.3 常见的弱电解质(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆中学2021届高三上学期期中考试化学试题四川省峨眉第二中学2020-2021学年高二下学期4月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题河南省宏力学校2021-2022学年高二上学期期末考试化学试题江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题
名校
解题方法
4 . 已知①相同温度下:Ksp[Zn(OH)2]>Ksp(ZnS),Ksp(MgCO3)>Ksp[Mg(OH)2];②电离出S2-的能力:FeS>H2S>CuS,则下列离子方程式错误的是
| A.将FeS加入稀盐酸中:FeS+2H+=Fe2++H2S↑ |
| B.向CuSO4溶液中通H2S气体:Cu2++H2S=CuS↓+2H+ |
| C.将ZnCl2溶液和Na2S溶液混合:Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
D.向少量Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2 +4OH-=Mg(OH)2↓+2 +4OH-=Mg(OH)2↓+2 +2H2O +2H2O |
您最近一年使用:0次
2020-12-11更新
|
796次组卷
|
12卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题黑吉两省十校2020-2021学年高二上学期期中联考(其他8校用)化学试题(已下线)3.4.1 难溶电解质的沉淀溶解平衡(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)课时1 沉淀溶解平衡及其应用2020年全国卷Ⅱ化学真题变式题山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题江西省宜春市丰城市第九中学2022-2023学年高二下学期开学质量检测化学试题山东省青岛第六十八中学2023-2024学年高二上学期期中考试化学试卷黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)(已下线)选择题1-5山东省青岛第十七中学2023-2024学年高二下学期期初考试化学试卷
5 . 化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:PbO2+4HCl=PbCl2+Cl2↑+2H2O;2FeCl3+H2S=2FeCl2+S↓+2HCl;复分解反应:KCN+CO2+H2O=HCN+KHCO3;热分解反应:4NaClO 3NaCl+NaClO4下列说法
3NaCl+NaClO4下列说法不正确 的是
 3NaCl+NaClO4下列说法
3NaCl+NaClO4下列说法| A.氧化性:PbO2> Cl2 | B.还原性:H2S > FeCl2 |
| C.酸性(水溶液):H2CO3> HCN | D.热稳定性:NaClO > NaClO4 |
您最近一年使用:0次
2020-12-04更新
|
63次组卷
|
2卷引用:福建省莆田第十五中学2019届高三上学期期中考试化学试题
6 . 碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO + H+的平衡常数K1=
+ H+的平衡常数K1=____ 。(已知10-5.60=2.5×10-6)
(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:____ 。
b.少量CO2通入过量的NaClO溶液中:____ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系( )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈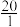 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_____ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将____ (填“变大、变小、不变”)。
(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为____ 之间

(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO
 + H+的平衡常数K1=
+ H+的平衡常数K1=(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:
b.少量CO2通入过量的NaClO溶液中:
(3)人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈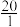 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为 的值将
的值将(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO
 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
您最近一年使用:0次
2020-11-26更新
|
761次组卷
|
6卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
名校
7 . 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) + OH﹣(aq) ═ H2O (l)△H=﹣57.3kJ•mol﹣1。分别向 1L 0.5mol•L﹣1 的 NaOH 溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应放出的热量分别为 Q1、Q2、Q3,下列关系正确的是
| A.Q1>Q3>Q2 | B.Q1<Q2<Q3 |
| C.Q1>Q2=Q3 | D.Q1=Q2<Q3 |
您最近一年使用:0次
2020-10-29更新
|
297次组卷
|
2卷引用:福建省龙海市第二中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . (1)分别写出Na2CO3、NaHCO3、NaOH、NaHSO4、HNO3在水溶液中及Na2O在熔融状态下的电离方程式。
Na2CO3:_______________________________
NaHCO3:_________________________________________
NaOH:__________________________________________
NaHSO4:__________________________________________
HNO3:_____________________________________________
Na2O:_____________________________________________
(2) 草酸钙(CaC2O4)是不能被人体吸收的沉积物。豆腐中含有较多的钙盐[如硫酸钙(CaSO4等),菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症。
① 由草酸的化学式可知其中碳元素的化合价是__________ 价。
② 草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4⟶CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙 反应的化学方程式:______________________________________________ 。
Na2CO3:
NaHCO3:
NaOH:
NaHSO4:
HNO3:
Na2O:
(2) 草酸钙(CaC2O4)是不能被人体吸收的沉积物。豆腐中含有较多的钙盐[如硫酸钙(CaSO4等),菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症。
① 由草酸的化学式可知其中碳元素的化合价是
② 草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4⟶CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙 反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 下列有关化学实验的叙述正确的是:
A. 与稀硝酸反应生成 与稀硝酸反应生成 ,推出 ,推出 也能与稀硝酸反应生成 也能与稀硝酸反应生成 |
B.配制 溶液时,通常向溶液中加入少量 溶液时,通常向溶液中加入少量 粉 粉 |
| C.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 |
| D.配制一定物质的量浓度的溶液,定容时仰视刻度线会使所配制的溶液浓度偏高 |
您最近一年使用:0次
名校
10 . 在25℃时两种酸的电离常数如下:H2CO3 :Ki1=4.2×10-7 , Ki2=5.6×10-11;
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
| A.NaHCO3+NaHS → Na2CO3+H2S↑ | B.H2S+Na2CO3 → NaHS+NaHCO3 |
| C.Na2S+H2O+CO2 → Na2CO3+H2S↑ | D.H2S+NaHCO3 → NaHS+H2CO3 |
您最近一年使用:0次
2020-03-23更新
|
348次组卷
|
9卷引用:福建省莆田第一中学2017-2018学年高二上学期期末考试化学试题
福建省莆田第一中学2017-2018学年高二上学期期末考试化学试题云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)上海市奉贤区2014届高三4月调研测试(二模)化学试题江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题(已下线)第1讲 弱电解质的电离平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)江苏省响水中学2021-2022学年高二下学期第一次学情分析考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高二下学期5月份月检测化学试题