名校
1 . 25℃时,醋酸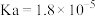 ;次氯酸
;次氯酸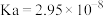 ;碳酸
;碳酸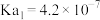 ,
,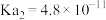 ;亚硫酸
;亚硫酸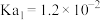 ,
,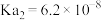 。
。
(1)写出亚硫酸的第二级电离平衡常数表达式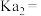
___________ 。
(2) 、
、 、
、 和
和 中结合
中结合 能力最强的是
能力最强的是___________ 。
(3)往 溶液中通入少量
溶液中通入少量 ,离子方程式为:
,离子方程式为:___________ 。
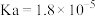 ;次氯酸
;次氯酸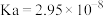 ;碳酸
;碳酸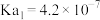 ,
,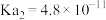 ;亚硫酸
;亚硫酸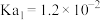 ,
,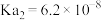 。
。(1)写出亚硫酸的第二级电离平衡常数表达式
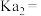
(2)
 、
、 、
、 和
和 中结合
中结合 能力最强的是
能力最强的是(3)往
 溶液中通入少量
溶液中通入少量 ,离子方程式为:
,离子方程式为:
您最近一年使用:0次
2023-06-05更新
|
243次组卷
|
2卷引用: 上海市第二中学2022-2023学年高二下学期5月阶段测试化学试题
名校
解题方法
2 . 室温下,取10mL0.1mol·L-1某二元酸H2A,滴加0.1mol·L-1 溶液。已知:H2A→H++HA-,HA-
溶液。已知:H2A→H++HA-,HA- H++A2-,下列说法不正确的是
H++A2-,下列说法不正确的是
 溶液。已知:H2A→H++HA-,HA-
溶液。已知:H2A→H++HA-,HA- H++A2-,下列说法不正确的是
H++A2-,下列说法不正确的是| A.0.1mol·L−1 H2A溶液中有c(H+)-c(OH−)-c(A2−)= 0.1mol·L−1 |
B.当滴加至中性时,溶液中c(Na+)=2c(A2−)+c(HA−),用去 溶液的体积小于10mL 溶液的体积小于10mL |
C.当用去 溶液体积10mL时,溶液的 溶液体积10mL时,溶液的 ,此时溶液中有c(A2−)=c(H+)-c(OH−) ,此时溶液中有c(A2−)=c(H+)-c(OH−) |
D.当用去 溶液体积20mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2−) 溶液体积20mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2−) |
您最近一年使用:0次
2023-04-12更新
|
425次组卷
|
4卷引用:上海市复旦大学附属中学2023届高三下学期开学阶段性集中练习化学试题
上海市复旦大学附属中学2023届高三下学期开学阶段性集中练习化学试题(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)湖南省岳阳县一中2023-2024学年高三开学考试化学试题
解题方法
3 . 将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是
A. 溶液 溶液 | B. 溶液 溶液 |
C.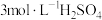 溶液 溶液 | D.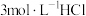 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
4 . NaCN超标的电镀废水可用两段氧化法处理:
第一次:NaCN与NaClO反应,生成NaOCN和NaCl;
第二次:NaOCN与NaClO反应,生成Na2CO3.CO2.NaCl和N2。
已知HCN是一种有剧毒的挥发性弱酸;HCN.HOCN中N元素化合价相同。
完成下列填空:
(1)HCN是直线型分子,HCN是_____ 分子(选填“极性”、“非极性”)。HClO的电子式为_______ 。
(2)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是_______ ;H、C、N、O、Na的原子半径从小到大的顺序为_________ 。
(3)第一次氧化时,溶液的pH应调节为_______ (选填“酸性”、“碱性”或“中性”);原因是_______ 。
(4)写出第二次氧化时发生反应的离子方程式:_________ 。
(5)处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO_______ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。
第一次:NaCN与NaClO反应,生成NaOCN和NaCl;
第二次:NaOCN与NaClO反应,生成Na2CO3.CO2.NaCl和N2。
已知HCN是一种有剧毒的挥发性弱酸;HCN.HOCN中N元素化合价相同。
完成下列填空:
(1)HCN是直线型分子,HCN是
(2)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是
(3)第一次氧化时,溶液的pH应调节为
(4)写出第二次氧化时发生反应的离子方程式:
(5)处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO
您最近一年使用:0次
名校
解题方法
5 . 科学家经过研究后发现,把水加热加压到 374℃、22.lMPa以上时具有很多特性, 如其中含有的氢离子浓度远远大于10-7mol/L,还具有很强的溶解有机物的能力。由此可知,处于这种状态下的水
| A.显中性, pH一定等于 7 | B.表现出非极性溶剂的特性 |
| C.显酸性,pH 一定小于 7 | D.表现出极性溶剂的特性 |
您最近一年使用:0次
17-18高二上·福建莆田·期末
名校
6 . 在25℃时两种酸的电离常数如下:H2CO3 :Ki1=4.2×10-7 , Ki2=5.6×10-11;
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
| A.NaHCO3+NaHS → Na2CO3+H2S↑ | B.H2S+Na2CO3 → NaHS+NaHCO3 |
| C.Na2S+H2O+CO2 → Na2CO3+H2S↑ | D.H2S+NaHCO3 → NaHS+H2CO3 |
您最近一年使用:0次
2020-03-23更新
|
348次组卷
|
9卷引用:上海市奉贤区2014届高三4月调研测试(二模)化学试题
(已下线)上海市奉贤区2014届高三4月调研测试(二模)化学试题福建省莆田第一中学2017-2018学年高二上学期期末考试化学试题云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题(已下线)第1讲 弱电解质的电离平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)江苏省响水中学2021-2022学年高二下学期第一次学情分析考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高二下学期5月份月检测化学试题
解题方法
7 . 硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____ Mn2++____ S2O82﹣+____ H2O→____ MnO4﹣+____ SO42﹣+______ H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______ (填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______ g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣ H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____ ,第4位的离子是____ 。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
____ (填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣⇌H++SO32﹣K=1.02×10﹣7,NH4++H2O⇌NH3•H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____ (选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3•H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3•H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3•H2O+SO32﹣
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在
(4)已知硫酸的第二级电离并不完全:HSO4﹣
 H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是
(5)已知:HSO3﹣⇌H++SO32﹣K=1.02×10﹣7,NH4++H2O⇌NH3•H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3•H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3•H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3•H2O+SO32﹣
您最近一年使用:0次
名校
8 . 能使Al(OH)3的电离平衡向碱式电离方向移动的是( )
| A.HNO3 | B.H2CO3 | C.NaOH | D.氨水 |
您最近一年使用:0次
2019-04-04更新
|
290次组卷
|
2卷引用:【区级联考】上海市杨浦区2019届高三下学期二模化学试题
12-13高三上·上海普陀·期末
9 . 根据下表提供的数据可知能大量共存的微粒组是
| 化学式 | 电离常数 |
| CH3COO | K=1.7×10-5 |
| HClO | K=3.0×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| A.H2CO3、HCO3-、CH3COO-、ClO- |
| B.HClO、 HCO3-、CH3COO-、ClO- |
| C.HClO 、HCO3-、ClO-、CO32- |
| D.HCO3- 、CH3COO-、ClO-、CO32- |
您最近一年使用:0次



