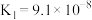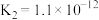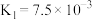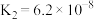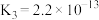22-23高三下·上海杨浦·开学考试
名校
解题方法
1 . 室温下,取10mL0.1mol·L-1某二元酸H2A,滴加0.1mol·L-1 溶液。已知:H2A→H++HA-,HA-
溶液。已知:H2A→H++HA-,HA- H++A2-,下列说法不正确的是
H++A2-,下列说法不正确的是
 溶液。已知:H2A→H++HA-,HA-
溶液。已知:H2A→H++HA-,HA- H++A2-,下列说法不正确的是
H++A2-,下列说法不正确的是| A.0.1mol·L−1 H2A溶液中有c(H+)-c(OH−)-c(A2−)= 0.1mol·L−1 |
B.当滴加至中性时,溶液中c(Na+)=2c(A2−)+c(HA−),用去 溶液的体积小于10mL 溶液的体积小于10mL |
C.当用去 溶液体积10mL时,溶液的 溶液体积10mL时,溶液的 ,此时溶液中有c(A2−)=c(H+)-c(OH−) ,此时溶液中有c(A2−)=c(H+)-c(OH−) |
D.当用去 溶液体积20mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2−) 溶液体积20mL时,此时溶液中有c(Na+)=2c(HA-)+2c(A2−) |
您最近一年使用:0次
2023-04-12更新
|
425次组卷
|
4卷引用:江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)
(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)上海市复旦大学附属中学2023届高三下学期开学阶段性集中练习化学试题(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖南省岳阳县一中2023-2024学年高三开学考试化学试题
2 . 硫化钠( )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: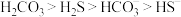 ;下列化学反应表示正确的是
;下列化学反应表示正确的是
 )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: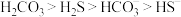 ;下列化学反应表示正确的是
;下列化学反应表示正确的是A. 溶液呈碱性: 溶液呈碱性: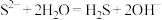 |
B. 与NaOH溶液反应: 与NaOH溶液反应: |
C. 与 与 溶液反应: 溶液反应: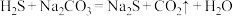 |
D.用足量炭还原硫酸钡制取硫化钡: |
您最近一年使用:0次
2022-11-11更新
|
198次组卷
|
3卷引用:江苏省连云港市2022-2023学年高三上学期期中调研考试化学试题
解题方法
3 . 实验室制备亚硫酸钠的过程如下:将饱和碳酸钠溶液加热到40°C,通入二氧化硫至饱和后,再加入碳酸钠固体,在避免与空气接触的情况下结晶而制得。
(已知:H2SO3:Ka1=1.5×10-2;Ka2=6.3×10-8;H2CO3:Ka1=4.4×10-7;Ka2=4.7×10-11)
下列说法正确的是
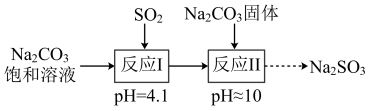
(已知:H2SO3:Ka1=1.5×10-2;Ka2=6.3×10-8;H2CO3:Ka1=4.4×10-7;Ka2=4.7×10-11)
下列说法正确的是

A.饱和Na2CO3溶液中存在c(Na+)+c(H+)=c(H2CO3)+c(HCO )+c(CO )+c(CO ) ) |
B.“反应I”的离子方程式为2CO +SO2+H2O=2HCO +SO2+H2O=2HCO +SO +SO |
C.“反应I”得到的溶液中有c(HSO )>c(SO )>c(SO ) ) |
| D.“反应II”中有大量气体产生 |
您最近一年使用:0次
名校
4 . 下表是几种弱酸常温下的电离平衡常数:
则下列说法中不正确的是
|
|
|
|
|
|
|
|
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释醋酸, 增大 增大 |
| D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变 |
您最近一年使用:0次
2021-12-02更新
|
414次组卷
|
21卷引用:江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题
江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题江苏省无锡市江阴市两校联考2023-2024学年高二下学期3月月考化学试题河北省邯郸市永年县第二中学2017-2018学年高二10月月考化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题黑龙江省大庆铁人中学2019-2020学年高二10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——弱电解质的电离四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题(已下线)3.1.3 常见的弱电解质(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆中学2021届高三上学期期中考试化学试题四川省峨眉第二中学2020-2021学年高二下学期4月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题河南省宏力学校2021-2022学年高二上学期期末考试化学试题
名校
5 . 下表是几种常见弱酸的电离平衡常数(25℃)
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HCN三种酸的酸性最强的是______ ,相同浓度的Na2CO3、CH3COONa、NaCN溶液pH最大的是______ 。
(2)常温下一定浓度的NaCN溶液pH=9,溶液中c(OH-)=______ ,用离子方程式表示NaCN溶液呈碱性的原因______ 。
(3)向NaCN溶液中通入少量CO2,反应的离子方程式是______ 。
(4)25℃时,某HCN和NaCN的混合液的pH=8,则溶液中c(HCN)与c(CN-)之比是______ ,该条件下NaCN的水解常数为______ 。(保留两位有效数字)
(5)实验室用酸碱中和滴定法测定某市售白醋的浓度
I.实验步骤
①配制待测白醋溶液
②量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂
③读取盛装0.1000 mol·L-1 NaOH溶液的碱式滴定管的初始读数
④滴定,判断滴定终点的现象是______ ,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3次。
II.实验记录
III.数据处理与讨论
⑤甲同学在处理数据时计算得:c(市售白醋)=______ mol·L-1。
⑥碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______ (填“偏小”“偏大”或“无影响”)。
| 化学式 | H2CO3 | CH3COOH | HCN |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 5.0×10-10 |
(2)常温下一定浓度的NaCN溶液pH=9,溶液中c(OH-)=
(3)向NaCN溶液中通入少量CO2,反应的离子方程式是
(4)25℃时,某HCN和NaCN的混合液的pH=8,则溶液中c(HCN)与c(CN-)之比是
(5)实验室用酸碱中和滴定法测定某市售白醋的浓度
I.实验步骤
①配制待测白醋溶液
②量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂
③读取盛装0.1000 mol·L-1 NaOH溶液的碱式滴定管的初始读数
④滴定,判断滴定终点的现象是
II.实验记录
| 实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
⑤甲同学在处理数据时计算得:c(市售白醋)=
⑥碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
您最近一年使用:0次
6 . 已知碳酸、亚硫酸、次氯酸的平衡常数如表,下列说法正确的是
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10−7 | K1=1.54×10−2 | K=2.95×10−8 |
| K2=5.61×10−11 | K2=1.02×10−7 |
| A.相同条件下,同浓度的H2SO3溶液和H2CO3溶液的酸性,后者更强 |
B.Na2CO3溶液中通少量SO2:2CO +SO2+H2O=2HCO +SO2+H2O=2HCO +SO +SO |
C.NaHCO3溶液中通少量SO2:HCO +SO2=CO2+HSO +SO2=CO2+HSO |
| D.向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
您最近一年使用:0次
7 . 碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO + H+的平衡常数K1=
+ H+的平衡常数K1=____ 。(已知10-5.60=2.5×10-6)
(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:____ 。
b.少量CO2通入过量的NaClO溶液中:____ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系( )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈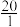 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_____ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将____ (填“变大、变小、不变”)。
(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为____ 之间

(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO
 + H+的平衡常数K1=
+ H+的平衡常数K1=(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:
b.少量CO2通入过量的NaClO溶液中:
(3)人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈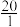 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为 的值将
的值将(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO
 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
您最近一年使用:0次
2020-11-26更新
|
761次组卷
|
6卷引用:江苏省启东市2020-2021学年高二上学期期中考试化学试题
解题方法
8 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
| B | 室温下,向NaCl和KI混合溶液中滴加AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的弱 |
| D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5 | HSO 结合H+的能力比SO 结合H+的能力比SO 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 在25℃时两种酸的电离常数如下:H2CO3 :Ki1=4.2×10-7 , Ki2=5.6×10-11;
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是
| A.NaHCO3+NaHS → Na2CO3+H2S↑ | B.H2S+Na2CO3 → NaHS+NaHCO3 |
| C.Na2S+H2O+CO2 → Na2CO3+H2S↑ | D.H2S+NaHCO3 → NaHS+H2CO3 |
您最近一年使用:0次
2020-03-23更新
|
348次组卷
|
9卷引用:江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题
江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题江苏省响水中学2021-2022学年高二下学期第一次学情分析考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高二下学期5月份月检测化学试题福建省莆田第一中学2017-2018学年高二上学期期末考试化学试题云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)上海市奉贤区2014届高三4月调研测试(二模)化学试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题(已下线)第1讲 弱电解质的电离平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)